作者简介:于美美(1996—),女,在读硕士,研究方向:微生物与肿瘤病毒免疫研究。 邵为林(2000—),男,本科在读,研究方向:临床医学。#邵为林同为第一作者
目的 构建EB病毒(Epstein-Barr virus, EBV)EBNA1和LMP1融合基因的重组腺病毒,探究重组腺病毒的免疫学作用。方法 以质粒pCXWB-EBNA1和pMV261-LMP1为模板,通过PCR扩增EBNA1和LMP1基因,并通过linker以重叠延伸PCR的方式构建融合基因EBNA1-LMP1,将其与腺病毒穿梭质粒pDC316-mCMV-EGFP通过双酶切、连接构建重组质粒EBNA1-LMP1-pDC316-mCMV-EGFP,并通过PCR、酶切和基因测序进行鉴定。将重组质粒EBNA1-LMP1-pDC316-mCMV-EGFP与包装质粒pBHGlox(delta)E1,3Cre转染293T细胞以获得重组腺病毒;通过Western blot检测融合基因EBNA1-LMP1在293T细胞中的表达;用重组腺病毒免疫C57BL/6J小鼠,测定小鼠体内CD4+T细胞、CD8+T细胞和细胞因子TNF-α、IFN-γ的比例,观察重组腺病毒的免疫效果。结果 通过PCR获得基因EBNA1(717 bp)和LMP1(1 161 bp),通过重叠延伸PCR获得EBNA1-LMP1 (1 923 bp)融合基因,经PCR、双酶切以及基因测序证实融合基因EBNA1-LMP1已成功插入腺病毒穿梭载体pDC316-mCMV-EGFP;Western blot表明融合基因在293T细胞中表达蛋白EBNA1和LMP1,大小约70 000。动物实验显示,重组腺病毒免疫组的脾CD4+T细胞、CD8+T细胞占总细胞的54.2%和39.2%;小鼠眼球血中重组腺病毒免疫组CD4+T淋巴细胞和CD8+T淋巴细胞占总细胞的54.2%和39.2%;而重组腺病毒免疫组的脾TNF-α和IFN-γ占总细胞因子的0.72%和7.63%,均高于对照组,差异均具有统计学意义( P<0.05)。结论 本实验成功获得了能稳定表达融合蛋白的重组腺病毒,动物实验显示重组腺病毒能有效刺激小鼠体内T淋巴细胞、B淋巴细胞的增殖和细胞因子TNF-α、IFN-γ的分泌。
Objective To construct recombinant adenovirus with Epstein-Barr virus (EBV) fusion gene expression vector containing EBV gene EBNA1 and LMP1, and to explore the immunological effect of recombinant adenovirus, so as to obtain a vaccine with certain preventive and therapeutic effects on EBV positive tumor.Methods Using plasmids pcxwb-EBNA1 and pMV261-LMP1 as templates, EBNA1 and LMP1 genes were amplified by PCR, and the fusion gene EBNA1-LMP1 was constructed by overlapping extension PCR through linker sequence. The recombinant plasmid EBNA1-LMP1-pDC316-mCMV-EGFP was constructed by double enzyme digestion and connection with adenovirus shuttle vector pDC316-mCMV-EGFP, and identified by PCR, enzyme digestion and gene sequencing. The recombinant plasmid EBNA1-LMP1-pDC316-mCMV-EGFP and the packaging plasmid pBHGlox(delta)E1,3Cre were transfected into 293T cells. The expression of fusion gene EBNA1-LMP1 in 293T cells was detected by Western blot; C57BL/6J mice immunized with recombinant adenovirus. After immunization, the eye blood and spleen of mice were taken to determine the proportion of CD4+T cells, CD8+T cells and cytokine TNF-α, IFN-γ, so as to obtain the immune effect of recombinant adenovirus.Results EBNA1 (717 bp) and LMP1 (1 161 bp) were obtained by PCR. EBNA1-LMP1 (1 923 bp) fusion gene was obtained by overlapping extension PCR. PCR, double enzyme digestion and gene sequencing confirmed that the fusion gene EBNA1-LMP1 had been successfully inserted into adenovirus shuttle vector pDC316-mCMV-EGFP; Western blot showed that the fusion gene expressed proteins EBNA1 and LMP1 in 293T cells, with a size of about 70 000. Animal experiments showed that the spleen CD4+T cells and CD8+T cells in the recombinant adenovirus immunized group accounted for 54.2% and 39.2% of the total cells, which was higher than that in the control group ( P<0.05). CD4+T lymphocytes and CD8+T lymphocytes in mouse eye blood immunized with recombinant adenovirus accounted for 54.2% and 39.2% of the total cells ( P<0.05). The spleen TNF-α and IFN-γ of recombinant adenovirus immunized group accounted for 0.72% and 7.63% of the total cytokines respectively, with statistical difference ( P<0.05).Conclusions The recombinant plasmid EBNA1-LMP1-pDC316-mCMV-EGFP is successfully constructed and transfected into 293T cells, and the recombinant adenovirus that can stably express the fusion protein. Animal experiments show that the recombinant adenovirus can effectively stimulate the proliferation of T and B lymphocytes and the cytokine TNF-α and IFN-γ in mice. It lays a foundation for the research of EBV positive tumor vaccine.
EB病毒(Epstein-Barr virus, EBV)感染人体主要有溶细胞性感染和潜伏性感染两种形式。溶细胞性感染即指EBV引起的急性增殖性感染。潜伏感染EBV基因组以环状DNA分子的形式存在于感染的细胞内[1]。EBV主要感染淋巴细胞和上皮细胞[2], 与Burkitt淋巴瘤、鼻咽癌、移植后淋巴增生性疾病、鼻型T/NK细胞淋巴瘤、霍奇金淋巴瘤等有关, 多项研究表明, 全球95%以上的人口感染过EBV[3, 4]。
本研究将EBV基因EBNA1和LMP1融合并与腺病毒穿梭质粒pDC316-mCMV-EGFP连接为重组质粒EBNA1-LMP1-pDC316-mCMV-EGFP, 使其在293T细胞中表达, 探究融合蛋白在C57BL/6J小鼠体内的免疫反应, 为研究疫苗奠定理论基础。
1.1.1 试剂 质粒小提试剂盒和琼脂糖凝胶DNA回收试剂盒购自天根生化科技有限公司, PrimeSTAR® GXL DNA Polymerase购自Takara, HRP标记兔抗鼠IgG二抗购自碧云天生物技术公司; 抗LMP1小鼠单克隆抗体购自abcam公司。
1.1.2 菌株与细胞株 E.coli.DH5α 感受态细胞购自北京天根公司; 293T细胞(购自南京科佰生物科技有限公司, 货号:CBP60439)为本实验室保存。
1.1.3 质粒 pCXWB-EBNA1质粒购自北京中源合聚生物科技公司; pMV261-LMP1为本室保存; pDC316-mCMV-EGFP穿梭质粒购自武汉淼灵生物科技有限公司。
1.1.4 实验动物 6~8周龄C57BL/6J小鼠购自济南金丰实验动物公司。
1.2.1 目的基因扩增
1.2.1.1 设计引物 F1:CGGCTAGCATGCCATTTTT CCACCCTGTAGGGG ANheⅠ ; R1:GCTGCCGCCAC CGCCGCTTCCGCCACCGCCGCTTCCACCGCCACCCTCCTGCCCTTCCTCACCCTCATCTC; F2:GGTGGCGGT GGAAGCGGCGGTGGCGGAAGCGGCGGTGGCGGCAGCATGGAACACGACCTTGAGAGGGGCCCACCG; R2:CGCAAGCTTTTAGTCATAGTAGCTTAGCTGAACTGGHindⅢ 。
1.2.1.2 扩增目的基因 分别以pCXWB-EBNA1质粒和pMV261-LMP1质粒为模板进行PCR扩增基因EBNA1和LMP1。扩增产物经1%琼脂糖凝胶电泳后进行琼脂糖凝胶DNA回收。
1.2.1.3 连接 获得的EBNA1基因和LMP1基因以T4 DNA Ligase连接, 于16 ℃金属浴过夜。扩增产物经1%琼脂糖凝胶电泳后进行琼脂糖凝胶DNA回收。
1.2.1.4 重叠PCR融合基因的获得 以连接后的融合基因为模板进行重叠延伸PCR, 扩增产物经1%琼脂糖凝胶电泳后进行琼脂糖凝胶DNA回收。
1.2.2 酶切及连接 将融合基因EBNA1-LMP1与穿梭质粒pDC316-mCMV-EGFP分别用限制酶NheⅠ 和HindⅢ 进行双酶切, 酶切产物经1%琼脂糖凝胶电泳后进行琼脂糖凝胶DNA纯化回收。再用T4 DNA Ligase将回收产物融合基因EBNA1-LMP1与穿梭质粒pDC316-mCMV-EGFP进行连接。
1.2.3 转化 将连接液与E.coli.DH5α 混匀, 冰浴 30 min, 42 ℃热激90 s, 冰浴10 min, 加入800 μ L LB培养基, 37 ℃ 160 r/min摇床1 h, 5 000 r/min(离心半径6 cm)离心3 min, 去上清后将沉淀混匀涂在含氨苄青霉素的固体LB培养基, 37 ℃培养12~18 h。
1.2.4 鉴定 取单菌落接种至含氨苄青霉素的LB液体培养基, 37 ℃ 160 r/min培养12~18 h。提取菌液的质粒, 进行PCR、双酶切鉴定。由上海生物工程股份有限公司进行测序。
1.2.5 重组腺病毒EBNA1-LMP1-pDC316的包装
1.2.5.1 脂质体DNA转染 将重组质粒EBNA1-LMP1-pDC316-mCMV-EGFP和包装质粒pBHGlox(delta)E1, 3Cre通过Lipofectamine 2 000共转染293T细胞, 观察细胞的生长状况。待大部分细胞出现细胞病变时, 收集细胞并冻融, 高速离心后收集病毒上清, 即为包装完成的原代重组腺病毒(P0)。
1.2.5.2 重组腺病毒的扩增 将P0代重组腺病毒接种至生长状况良好的293T细胞中培养, 待大部分细胞出现细胞病变时, 收集细胞及培养液, 反复冻融后收集上清即为P1代重组腺病毒, 以同样方法进行腺病毒传代, 收获P2代、P3代等稳定传代的腺病毒。
1.2.6 融合蛋白的提取和鉴定 收集已感染腺病毒的293T细胞使用RIPA细胞裂解液(含PMSF)冰上裂解30 min, 4 ℃ 1 200 r/min(离心半径6 cm)离心后收集上清中的蛋白质, 进行SDS-PAGE电泳, 80 V 45 min后120 V 45 min, 利用湿转法将蛋白质转膜至PVDF膜上, 100 V 2 h。用3% BSA封闭2 h, 加入抗LMP1(或抗EBNA1)抗体4 ℃过夜、洗膜, HRP标记兔抗鼠抗体室温孵育2 h, 洗膜, 观察曝光结果。
1.2.7 免疫小鼠 将15只C57BL/6J雌鼠平均分为3组, 分别为实验组(重组腺病毒EBNA1-LMP1-pDC316-mCMV-EGFP)、PBS对照组(PBS缓冲液)、空载体对照组(空载体pDC316-mCMV-EGFP), 腿部肌肉分别注射200 μ L腺病毒或PBS, 初次免疫15 d后进行加强免疫, 15 d后处死小鼠。
1.2.7.1 流式细胞术检测T淋巴细胞 末次免疫15 d后, 取小鼠眼球血和脾脏进行研磨、红细胞裂解和过滤, 用PBS重悬为细胞悬液, 加入CD3、CD4、CD8a抗体, 4 ℃下避光孵育30 min, PBS洗涤后进行流式细胞仪检测。
1.2.7.2 流式细胞术检测细胞因子 将小鼠脾细胞悬液用RPMI1640培养基活化培养6 h, 用PBS洗涤、固定, 破膜后加入TNF-α 、IFN-γ 抗体, 4 ℃下避光孵育 1 h以上, 用PBS洗涤后流式细胞仪检测。
符合正态分布的计量数值使用 x± s进行描述, 采用 SPSS 20.0 进行相关统计学分析, 采用单因素方差分析比较多样本均数之间的差异, 如差异有统计学意义, 则采用 SNK 检验进行多组间两两比较, 分析使用双侧检验, 以P< 0.05为差异有统计学意义。
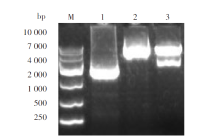
PCR扩增基因EBNA1和LMP1与预期基本一致, LMP1为1 161 bp, EBNA1为717 bp(图1A)。重叠延伸PCR扩增融合基因EBNA1-LMP1大小为717+1 161+45=1 923 bp, 与预期相同(图1B)。
转化后提取重组质粒进行的PCR鉴定和酶切鉴定(图2), PCR鉴定获得约2 000 bp左右的PCR片段, 双酶切获得长度约为2 000 bp和 5 800 bp的酶切片段, 均与预期相符。
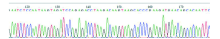
将酶切和PCR鉴定正确的重组质粒送至上海生工测序, 测得的碱基序列与生物公司提供的产品序列基本一致(图3)。
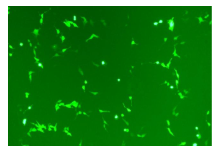
将重组质粒EBNA1-LMP1-pDC316-mCMV-EGFP与包装质粒pBHGlox(delta)E1, 3Cre通过Lipofectamine 2000共转染293T细胞, 待细胞CPE现象达到70%~80%时, 回收腺病毒。图4为倒置荧光显微镜下共转染后细胞形态。
重组腺病毒转染293T细胞后, 破碎细胞提取细胞总蛋白, 经过Western blot目的蛋白的表达, 结果显示转染重组质粒EBNA1-LMP1-pDC316-mCMV-EGFP的细胞表现为蛋白质部分表达, 即抗LMP1阳性(或抗EBNA1阳性), 大小约70 000, 而转染了空载体pDC316-mCMV-EGFP的细胞则没有表达。见图5。
结果显示(图6), 实验组小鼠脾脏的CD4、CD8+T淋巴细胞百分率分别为54.23%和39.25%, PBS对照组和空载体对照组百分率分别为38.21%、28.24%和34.93%、30.92%; 实验组小鼠眼球血的CD4+T淋巴细胞和CD8+T淋巴细胞百分率分别为54.19%和39.18%, PBS对照组和空载体对照组百分率分别为38.72%、27.23%和35.04%、31.16%, 实验组和两组对照组差异均有统计学意义(P< 0.05)。
实验组小鼠脾脏的TNF-α 、IFN-γ 百分率分别为0.72%和7.63%, PBS对照组和空载体对照组百分率分别为0.15%、2.56%和0.54%、2.80%。实验组和两对照组实验结果的差异均有统计学意义(P< 0.05)。见图7。
自1964年Epstein和Barr首次成功地将EBV从Burkitt非洲儿童淋巴瘤细胞分离出来后, EBV逐渐为人所熟知。而由于EBV阳性肿瘤目前并没有彻底预防和治疗的方法和途径。因此, 制备一种能有效预防EBV阳性肿瘤发生发展的疫苗十分必要。
EBV潜伏膜蛋白1(LMP1)是一种可以同时在显性感染和隐性感染中表达的信号蛋白[5, 6], 可通过影响核受体介导或G蛋白耦联受体介导的信号转导通路的转导效率, 来影响EBV相关肿瘤的转移、转化以及形成[5, 6, 7, 8, 9, 10]。同时, LMP1具有多种HLAⅠ 、HLAⅡ 分子限制性的T细胞表位, 这些表位有利于T细胞对癌细胞的结合与裂解清除[11]。在本研究中, LMP1所具有的HLA分子限制表位所表达的蛋白可以被EBV阳性的霍奇金淋巴瘤和鼻咽癌患者体内的LMP1特异性细胞毒性T淋巴细胞识别, 产生强烈的CTL应答[12], 尉秀霞等[13]于2012年进行的关于LMP1Δ DNA疫苗的临床研究, 也得到了类似的结论, 因此, LMP1编码的蛋白通过刺激机体的特异性免疫应答, 刺激CTL大量增殖并产生杀伤作用, 在EBV阳性肿瘤的治疗和预防具有重要作用。EBV核抗原1(EBNA1)是一种DNA结合蛋白, 由641个氨基酸组成, 在EBV各种潜伏状态下均可表达[1], 能稳定病毒环状附加体, 维持基因在细胞增殖过程中不丢失[14]。有研究表明, 调节信号通路, 改变基因的转录程序的EBNA1可使EBV持续处于潜伏感染却不影响细胞中其他基因的表达[15]。EBNA1编码蛋白刺激机体产生的特异性T细胞能有效杀伤EBV阳性肿瘤细胞, 而这也是目前EBV治疗型疫苗的主要研究重点[16]。本研究构建的重组腺病毒疫苗可在小鼠体内表达EBNA1蛋白, 作为抗原活化小鼠的特异性细胞免疫, 使小鼠自身产生EBNA1特异的T淋巴细胞, 通过破坏EBNA1达到间接杀灭EBV的目的。
大量实验数据已经表明, 双联甚至多联的融合蛋白增强机体对此抗原免疫能力的效果远远强于单基因[17]。因此, 本实验将LMP1和EBNA1两基因借助Linker连接在一起, 既降低了基因融合的难度, 又不会影响两基因各自的表达, 这是本研究的创新点之一; 再者, 自20世纪80年代至今, 腺病毒载体逐渐被广泛应用于基因工程疫苗、基因治疗等领域[18, 19], 其具有宿主范围广、免疫原性好、持续时间长、易于储存和成本低廉等优点[20], 本研究采用的pDC316-mCMV-EGFP载体属于腺病毒AdMax系统, 与目前使用最普及的腺病毒AdEasy系统相比, AdMax系统还具有出毒时间短(2~4周)、转染成功率高(> 98%)、实验操作简单、目的基因表达水平高等独特优点[19]。
根据以往的研究, LMP1和EBNA1两基因疫苗作为治疗型疫苗, 均以刺激机体免疫应答的方式杀伤EBV阳性的肿瘤细胞。本研究中, 作者通过PCR、双酶切和基因测序成功构建重组腺病毒穿梭载体EBNA1-LMP1-pDC316-mCMV-EGFP, 同时其在293T细胞中成功表达重组腺病毒融合蛋白, 证实了重组腺病毒能成功表达出EBNA1-LMP1融合蛋白。而在小鼠免疫实验中, 重组腺病毒免疫组小鼠的脾脏CD4+T细胞、CD8+T细胞的百分含量(54.23%和39.25%)高于PBS对照组(38.21%和28.24%)和空载体pDC316-mCMV-EGFP对照组(34.93%和30.92%), 且差异有统计学意义, 说明重组腺病毒能刺激小鼠免疫系统CD4+T淋巴细胞和CD8+T淋巴细胞的增殖, 小鼠眼球血中CD4+T淋巴细胞和CD8+T淋巴细胞的百分含量差异, 亦从侧面证明了重组腺病毒免疫可促进小鼠体内的淋巴细胞增殖; 另一方面, 小鼠脾脏的TNF-α 和IFN-γ 的流式分析也取得了较理想的结果, 重组腺病毒免疫组小鼠的脾脏TNF-α 和IFN-γ 的百分含量(0.72%和7.63%)高于PBS对照组(0.15%和2.56%)和空载体pDC316-mCMV-EGFP对照组(0.54%和2.80%), 表明重组腺病毒刺激小鼠体内TNF-α 和IFN-γ 的分泌。由此我们能发现, 重组腺病毒EBNA1-LMP1-pDC316-mCMV-EGFP能刺激小鼠体内免疫系统中CD4+T淋巴细胞和CD8+T淋巴细胞以及TNF-α 和IFN-γ 等细胞因子的分泌, 为构建EBV阳性肿瘤的腺病毒疫苗提供了有利的免疫学基础。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|