作者简介:张琛(1998—),女,硕士在读,研究方向:病毒与宿主相互作用。
目的 评价多种受体酪氨酸激酶抑制剂舒尼替尼(sunitinib)在体内和体外治疗流行性乙型脑炎病毒(Japanese encephalitis virus, JEV)感染的效果。方法 4周龄BALB/c小鼠腹腔注射JEV。感染小鼠以两种给药策略进行治疗,分别为连续5 d和连续10 d给与舒尼替尼治疗,后观测其体重变化和生存率;通过qRT-PCR技术检测小鼠脑内病毒RNA载量的变化;利用免疫组织化学染色技术检测小鼠脑内CD4+T淋巴细胞和CD8+T淋巴细胞的数量及分布;利用免疫荧光染色技术观察药物治疗前后小鼠脑内JEV病毒E蛋白的表达。此外,通过JEV体外感染Vero细胞并给与一定浓度舒尼替尼进行干预,观察细胞存活状态;采用间接免疫荧光染色观察治疗前后细胞内JEV病毒E蛋白的表达。结果 小鼠感染JEV后连续给与舒尼替尼可显著提高其生存率,并且连续给药5 d的生存率和体重变化结果优于连续给药10 d。舒尼替尼治疗后减少了脑内CD4+T淋巴细胞和CD8+T淋巴细胞浸润,小鼠脑内血管套袖样改变减轻;但治疗前后小鼠脑内的JEV病毒载量和脑内E蛋白的表达变化不太明显;感染JEV的Vero细胞在给与舒尼替尼后细胞病变效应稍有减轻,E蛋白表达少量变化。结论 舒尼替尼治疗能够显著降低JEV感染小鼠死亡率,并且连续给与舒尼替尼5 d的治疗效果更好,JEV感染小鼠接受舒尼替尼治疗后可减少脑内CD4+T淋巴细胞和CD8+T淋巴细胞浸润,改善脑内血管袖套样炎性炎症状,延长小鼠生命。
Objective To evaluate the effects of sunitinib on Japanese encephalitis virus (JEV) infection in vitroand vivo.Methods The 4-week-old BALB/c mice infected with JEV by intraperitoneal injection. The infected mice were treated with sunitinib for 5 days and 10 days respectively. After that, the change of weight and survival rate were evaluated continuously. The viral load variation in mice brain were detected by qRT-PCR. Indirect immunohistochemical staining assay (IFA) was used to detect the number and distribution of CD4+/CD8+T cells in mouse brain. IFA was also used to observe the expression of virus E protein in the brain of mice. Vero cells were infected with JEV in vitro and given a certain concentration of sunitinib to observe the cell survival status. The expression of virus E protein in cells was detected by IFA.Results Continuous administration of sunitinib significantly improved the survival rate of infected mice. Survival rate and body weight changes showed that the 5-day's administration strategy was significantly better than the 10-day's administration strategy. The treatment of sunitinib decreased the infiltration of CD4+/CD8+T cells in the brain and reduced the changes of vascular sleeve. However, the variation of viral load and E protein expression in brain were not obvious. The cytopathic effect (CPE) of infected Vero cells were slightly relieved after giving sunitinib, and the expression of E protein was also slightly changed.Conclusion Sunitinib can significantly reduce the mortality of infected mice, and the 5-day's administration strategy is significantly better than the 10-day's administration strategy. Sunitinib decrease T lymphocyte infiltration in brain of mice, relieve the encephalitis symptoms ,and prolonged the life of mice.
流行性乙型脑炎病毒, 亦称日本脑炎病毒(Japanese encephalitis virus, JEV)是引起流行性乙型脑炎(简称“ 乙脑” )的病原体[1]。0.1%~1.0%的JEV感染者会发生脑炎, 病死率高达20%~30%, 30%~40%幸存者患有永久性神经系统后遗症[2, 3]。虽然近年来乙脑病例呈下降趋势[4, 5, 6], 也已有疫苗[7], 但目前没有靶向治疗药物, 这意味着受感染人群仍无有效的治疗措施。因此, 为更快筛选出治疗JEV感染的抗病毒药物, 研究针对多种病毒宿主功能的已批准药物可减少获得广谱抗病毒药物的时间和成本[8]。
JEV与西尼罗病毒(West Neil virus, WNV)、寨卡病毒(Zika virus, ZIKV)和登革病毒(dengue virus, DENV)同属于黄病毒科黄病毒属[9]。JEV感染后常引起发热性疾病和不同程度的中枢神经系统病变[10, 11]。乙脑的发病机制复杂, 包括神经侵袭、神经炎症和神经元损伤; 目前公认的说法是, JEV突破血脑屏障(blood-brain barrier, BBB)进入中枢神经系统, 随后刺激免疫细胞和胶质细胞(小胶质细胞和星形胶质细胞)产生神经炎症反应[12]。在免疫细胞中, T淋巴细胞介导的细胞杀伤性作用在JEV的清除中有重要作用。但有报道称, 死于日本脑炎的成人和儿童, 其脑及脑脊液中含有大量CD4+T细胞和CD8+T细胞[13, 14, 15, 16, 17, 18]。表明CD4+T细胞和CD8+T细胞在日本脑炎中可能具有致病性, 过度的免疫反应可能会加速病情的发展[19, 20]。
病毒进入细胞的第一道物理屏障是宿主细胞的质膜, 大部分病毒通过内吞(endocytosis)途径进入宿主细胞[21, 22, 23, 24]。网格蛋白介导型内吞作用(clathrin-mediated endocytosis, CME)是病毒进入宿主细胞最常见的途径[25]。在此过程中, 网格蛋白衔接蛋白(adaptor protein, AP-2)、AP-2相关蛋白激酶1(AAK1)和宿主细胞的周期蛋白G相关激酶(GAK)可调节病毒的进入、组装和释放过程[8, 26, 27, 28, 29]。近年来已获批的抗癌药物厄洛替尼(erlotinib)和舒尼替尼(sunitinib)能够分别有效抑制GAK和AAK1[30, 31, 32]。有研究数据表明, 小鼠静脉给药时, 舒尼替尼在大脑中具有非常快速的原始积累, 并且随后在脑和血浆内的清除率相对较低[33, 34]。此外有实验证明, 舒尼替尼在DENV感染小鼠模型中起到一定保护作用, 治疗后小鼠病毒血症减轻, 生存时间延长, 且舒尼替尼在体外试验中对WNV感染也具有剂量依赖性的抑制作用[34]。JEV与WNV、DENV同属于黄病毒, 那么舒尼替尼对JEV是否有相似的作用呢?
本研究通过体内和体外实验综合评价舒尼替尼的治疗效果, 利用qRT-PCR、免疫组织化学和HE染色等方法观察用药前后小鼠脑内变化。结果表明舒尼替尼治疗能够显著降低JEV感染小鼠死亡率, 减少脑内T淋巴细胞浸润, 改善脑炎症状。本文为舒尼替尼作为JEV抗感染药物提供了依据, 为JEV感染治疗药物的筛选提供了参考。
1.1.1 实验动物 本实验所用4周龄BALB/c小鼠购自北京维通利华实验动物技术有限公司。小鼠的饲育、维持、以及实验处理均在首都医科大学SPF级动物实验设施中进行。
1.1.2 病毒 研究所用JEV病毒为Beijing-1株, 由本实验室保存。
1.1.3 药物及其他试剂 苹果酸舒尼替尼(sunitinib malate), 分子式C26H33FN407, 购自阿拉丁公司(货号:341031-54-7); RPMI1640培养基、胎牛血清(FBS)、青-链霉素购自Gibco公司; HE染色试剂购自索莱宝公司(货号G110); 兔源CD4抗体购自Abcam公司(货号ab183685), 兔源CD8a抗体购自Abcam公司(货号ab199016); 鼠源4G2抗体由本实验室制备保存; 山羊抗鼠Alexa Fluor® 488抗体购自Invirogen公司(货号A11055); 探针法Quant一步法反转录-荧光定量试剂盒购自TIANGEN公司(货号FP304); TansZol试剂盒购自TransGen公司(货号ET101); 辣根过氧化物酶标记的山羊抗兔抗体购自中山金桥公司(货号PV-9001)。
1.2.1 实验组设置 药物处理天数优化:实验动物选用4周龄BALB/c小鼠, 雌雄各半, 随机分为3组, 每组10只。实验组分为前5 d给药组(sunitinib 5 d组)和10 d给药组(sunitinib 10 d 组), 于腹腔注射舒尼替尼 0.015 mg, 1次/1 d , 分别连续给药5 d和10 d。对照组(PBS组)腹腔注射同等剂量的PBS溶液, 1次/1 d, 共 5 d。在给与舒尼替尼后第2天, 实验组和对照组均腹腔注射106PFU JEV。小鼠病毒感染及药物处理实验设置对照组(PBS组)和前5 d给药组(sunitinib 5 d组)。
1.2.2 细胞培养及病毒增殖 C6/36细胞(白纹伊蚊幼虫细胞)由本实验室保存, 基础培养基为RPMI1640培养基, 常规培养用含10% 胎牛血清和1% 青-链霉素双抗的RPMI1640培养基; 增殖病毒用含2% FBS和1% PS的RPMI1640培养基。置于28 ℃、含5% CO2的恒温培养箱中培养。Vero细胞(非洲绿猴肾细胞)由本实验室保存, 基础培养基为MEM培养基, 常规培养用含5% FBS和1% PS的MEM培养基; 病毒感染用含2% FBS和1% PS的MEM培养基。置于37 ℃、含5% CO2的恒温培养箱中培养。JEV的增殖在C6/36细胞上进行, 增殖后的JEV病毒放于-80 ° C冻存。
1.2.3 小鼠脑内病毒载量检测 采用TansZol试剂盒提取脑组织中的总RNA。采用探针法Quant一步法反转录-荧光定量试剂盒检测脑组织中病毒RNA的绝对定量; 探针序列为:5'-FAM-CCACGCCACTCGACCCATAGACTG-TAMRA-3'; 正向引物(JENS3F):5'-AGAGCACCAAGGG AATGAAATAGT-3'; 反向引物(JENSR):5'-AATA GGTTGTAGTTGG GCACTCTG-3', 按照试剂说明配置20 μ L反应体系, 在ABI7500平台上完成qRT-PCR, 以病毒拷贝数的对数作为y轴, Ct值作为x轴, 绘制标准曲线, 导出回归方程。将每个样本的Ct值代入方程得到脑组织中病毒载量, 表示为JEV拷贝数/μ g总RNA。
1.2.4 小鼠脑组织切片HE染色 组织标本经4%多聚甲醛固定、石蜡包埋, 制成厚度为4 μ m的石蜡切片; 切片通过常规脱蜡、水化; 再经苏木素染色细胞核, 伊红染色细胞质; 最后经过水化透明, 中性树脂封片, 在光镜下阅片。
1.2.5 小鼠脑组织切片免疫组织化学染色 组织标本经4%多聚甲醛固定、石蜡包埋后, 制成厚度为4 μ m的石蜡切片; 切片经常规脱蜡、水化; 再经枸橼酸盐缓冲液(pH 6.0)高温修复、30% H2O2室温封闭、1% Triton打孔、滴加1% BSA封闭; 后加兔抗鼠CD4或CD8抗体(1∶ 400稀释), 经4 oC孵育过夜; 次日切片经PBS洗涤后, 加入辣根过氧化物酶标记的山羊抗兔二抗, 室温孵育30 min; 后经PBS洗涤、DAB显色, 最后经过水化透明, 中性树脂封片, 在光镜下阅片。后计数100倍镜下15个视野中的CD4+T细胞, CD8+T细胞的数量。
1.2.6 小鼠脑组织切片间接免疫荧光染色 组织标本经4%多聚甲醛固定、石蜡包埋, 制成厚度为4 μ m的石蜡切片; 切片通过常规脱蜡、水化、枸橼酸盐缓冲液(pH 6.0)高温修复、1% Triton打孔、1% BSA封闭; 后滴加鼠源JEV E蛋白4G2单克隆抗体(1∶ 400倍稀释), 于4 oC冰箱孵育过夜; 次日滴加山羊抗鼠Alexa Fluor® 488抗体(1∶ 1 000倍稀释)室温孵育1 h; 后经PBS洗涤后, 滴加含DAPI的荧光封片剂; 封片后在荧光显微镜下阅片。
1.2.7 细胞体外感染及药物干预实验 Vero细胞于含有5% FBS的MEM常规培养基中培养, 待生长状况良好时铺于24孔板, 当细胞长至90%融合度时感染JEV(MOI=1), 以未感染JEV的细胞作为对照组(MOCK), 以感染JEV但进行未药物干预的细胞作为感染组(JEV), 以感染JEV且进行药物干预(舒尼替尼5 d给药)的细胞作为治疗组(sunitinib+JEV), 每组设置3个复孔。后将24孔板放于37 ℃、5% CO2的细胞培养箱中吸附1 h(每隔15 min摇匀1次), 病毒吸附完成后, 将治疗组Vero细胞用浓度为10-3μ mol/L的舒尼替尼进行药物干预, 后放于37 oC、5% CO2细胞培养箱中培养24 h。
1.2.8 细胞间接免疫荧光染色 Vero细胞经4%多聚甲醛固定、1% Triton打孔、1% BSA封闭; 后滴加鼠源JEV E蛋白4G2单克隆抗体(1∶ 400倍稀释), 放置于4 oC冰箱孵育过夜; 次日滴加山羊抗鼠Alexa Fluor® 488荧光二抗(1∶ 1 000倍稀释)室温孵育1 h; 经PBS洗涤后, 滴加含DAPI的荧光封片剂, 在荧光显微镜下观察。
1.2.9 统计学分析 采用统计软件GraphPad Prism 8.0.1进行统计分析, 总体生存率采用Kaplan-Meier法计算, 体重变化和小鼠脑内病毒RNA载量采用双因素方差分析法, CD4及CD8阳性细胞计数采用Mann-Whitney 检验。P<0.05为差异有统计学意义。
1.2.10 动物福利和伦理声明 本研究中与动物相关的实验方案均在首都医科大学实验动物福利和伦理委员会进行备案。动物实验过程中, 在实验允许的情况下, 尽可能地减少动物用量, 增加单个动物的利用度。小鼠在处死前均先行用 3.5%水合氯醛进行麻醉处理以减轻动物处死时的痛苦。
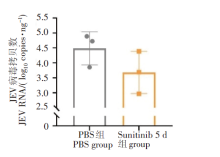
两实验组生存率均为90%, 但在体重变化上连续治疗5 d实验组差异更显著。表明舒尼替尼在动物体内能够有效提高生存率, 且连续治疗5 d的效果更好(图1)。因此, 我们给BALB/c小鼠攻毒JEV后, 连续5 d腹腔注射舒尼替尼, 并记录每日体重变化。对照组给与等量PBS溶液。实验结果显示, 在攻毒后第6天, 两组小鼠均开始发病。对照组小鼠体重连续下降, 在攻毒后第15天较体重最高点降低10%左右。sunitinib 5 d组小鼠的体重在攻毒后保持稳定, 在第12天才略有下降, 后又回升至接近最高时水平。与体重变化相比, 小鼠生存率变化更显著。对照组在攻毒后第5天起陆续死亡, 在攻毒15 d后, 生存率已降至50%, 而sunitinib 5 d组小鼠生存率则为80%(P<0.01), 表明舒尼替尼能够明显减轻JEV感染造成的死亡。见图2。
 | 图1 不同舒尼替尼给药天数对小鼠生存率和体重变化的影响Fig. 1 Survival rate and body weight changes of mice on different days of sunitinib administration |
结果表明, 经过舒尼替尼治疗后, 小鼠脑内病毒的RNA水平呈现下降趋势, 但与对照组相比差异无统计学差异(P>0.05)。见图3。
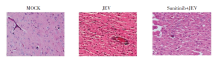
相较于感染组, 治疗组小鼠的脑组织切片经HE染色后血管套袖样改变明显减少, 且染色较感染组颜色浅, 这一现象表明, 舒尼替尼治疗可缓解小鼠脑炎症状。见图4。
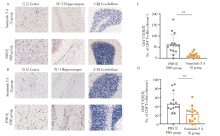
相较于PBS组, 舒尼替尼组小鼠脑组织切片中的CD4+T细胞与CD8+T细胞数量明显减少, 且这种变化在大脑皮层、海马区及小脑部位均存在。计数结果显示, 舒尼替尼治疗组与PBS组相比, CD4+T细胞和CD8+T细胞分别减少45%和23%, 均具有统计学差异。这一结果表明, 舒尼替尼可通过减少脑内炎性细胞浸润而缓解JEV感染造成的脑炎。见图5。
舒尼替尼治疗组与PBS组相比, 脑内JEV抗原表达在小鼠大脑皮层、海马区及小脑均有不同程度减少。这一结果提示, JEV感染小鼠在舒尼替尼治疗后, 脑内JEV病毒复制减轻。见图6。
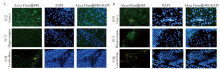
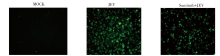
未感染的对照组(MOCK)没有出现细胞病变效应; JEV感染组(JEV) 在感染2 h后出现严重病变效应, 细胞有大量脱落; 舒尼替尼治疗组的受感染细胞虽然也出现一定病变效应, 但程度较感染对照组轻。见图7。
JEV感染后造成的乙型脑炎在所有年龄人群均可发病, 病死率高达20%~30%, 严重者甚至死亡。因此, 寻找具有潜在治疗效果的药物, 对于治疗JEV感染具有十分重要的意义。
本实验中, 小鼠的生存率和体重变化显示, 舒尼替尼能够明显减轻JEV感染造成的死亡, 延长生存时间。此外, 小鼠脑切片中的CD4+/CD8+T细胞在舒尼替尼治疗后明显减少。有报道称, 死于日本脑炎的成人和儿童, 其脑及脑脊液中含有大量CD4+T细胞和CD8+T细胞[13, 14, 15, 16, 17, 18]。这些结果表明CD4+T细胞和CD8+T细胞在日本脑炎中可能具有致病性。根据实验结果, 我们推测舒尼替尼可能通过减少T淋巴细胞的浸润缓解脑炎症状, HE染色也证实了这一结果。日本脑炎的病理学特征主要为血管套袖样改变和血管渗漏, 有时伴有少量出血, 以及小面积的局灶性坏死[16, 18, 35]。本实验中的HE染色结果显示舒尼替尼治疗后小鼠脑内血管套袖样改变减少, 表明小鼠的脑炎症状有一定程度缓解。
由于病毒在脑内广泛分布[35, 36], 我们通过qRT-PCR的方法检测小鼠整个脑内病毒载量变化, 发现经舒尼替尼治疗后脑内病毒载量略有所下降, 但变化并不明显。同时, 舒尼替尼体外抑制实验结果显示, 尽管治疗后细胞病变作用有所改善, 但JEV在Vero细胞中的复制并无太大改变, 这可能说明舒尼替尼并不直接作用于病毒复制, 其对JEV的抑制有一定的局限性。
尽管有报道称[34], 舒尼替尼在体外实验中可以剂量性抑制WNV感染。但我们的实验结果表明舒尼替尼对JEV未起到相同效果。这可能与实验所使用的药物剂量有关, 也可能是舒尼替尼在这两种病毒中的作用机制不同所导致。此外, 该实验还发现一些有趣的科学现象, 在舒尼替尼治疗后的T细胞变化中, CD4+T细胞减少更为明显, 这背后的原因值得我们进一步思考。在研究之初, 我们根据已发表文献推测舒尼替尼可能抑制JEV的复制, 但从实验结果来看, 舒尼替尼可能更多的是抑制淋巴细胞的浸润。在接下来的研究中, 我们将分析舒尼替尼处理对脑内细胞因子、转录组等的影响, 希望能够深入阐明舒尼替尼抑制JE发生的机制。综上所述, 本研究结果表明, 舒尼替尼具有抗JEV感染的保护作用, 同时鉴于其在其他黄病毒上也有相似的抗病毒作用, 该药物可能具有更加广泛的抗病毒疗效。本研究为舒尼替尼作为广谱黄病毒抗感染药物提供了依据, 并对广谱抗病毒药物的筛选具有一定参考意义。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|