作者简介:蔡武卫(1966—),男,本科,副主任技师,研究方向:寄生虫病防治。
目的 比较直接组织匀浆法和肺检法检测福寿螺广州管圆线虫检出率, 寻找简便快捷适合不同场境的检测方法。方法 在前辈报道已确认的疫区的水塘、沟渠、河流边等环境,捕捞收集福寿螺。每只螺逐只称重后,分别解剖成螺肺囊与肌肉两部分,先用肺检法镜检每只螺肺囊内是否有结节进行初筛,把结节用解剖针挑出单独压片用显微镜查找虫体,并在显微镜下鉴定虫种,然后再把肺囊和螺肉一起用组织匀浆法复检。结果 共检测330只福寿螺,组织匀浆法检出广州管圆线虫Ⅲ期幼虫的福寿螺63只,检出率为19.1%(63/330),肺检法查见结节的福寿螺52只,检出率为15.8%(52/330),其中肺检法查见结节并查到幼虫的福寿螺36只,其匀浆法也全部阳性,符合率100%(36/36);肺检法查见结节但未查到幼虫的福寿螺16只,其中有6只匀浆法阳性,10只匀浆法阴性,错检率19.2%(10/52 );肺检法未查见结节福寿螺278只,但用匀浆法检查有21只检出广州管圆线虫Ⅲ期幼虫,漏检率7.6%(21/278)。匀浆法与肺检法(以查见结节判定阳性为标准)比较,两者之间差异无统计学意义(χ2=1.27, P= 0.26, P>0.05)。匀浆法与肺检法(以查到幼虫判定阳性为标准)比较,两者之间差异有统计学意义(χ2=8.66, P=0.003, P<0.01)。两种方法对不同体质量的福寿螺广州管圆线虫检出率比较,结果显示肺检法2种判定方法在检测大螺(≥25 g)时与匀浆法比较其检出率之间差异都没有统计学意义(χ2=0.08, P=0.777; χ2=2.58, P=0.108),但在检测小螺(≤10 g)方面与匀浆法比较其检出率之间差异有统计学意义(χ2=5.63, P=0.02)。结论 肺检法的检测效果与组织匀浆法相比, 在检测大螺方面方法简单所需仪器设备更少,其检测速度更快, 适合广州管圆线虫的自然疫源地现场调查。而直接组织匀浆法灵敏度高,能直观地显示虫态与活度,虫体活力强,检出率高,更适合用在食品安全风险监测方面。
Objective To compare the efficiency of lung-microscopy and tissue homogenate in the detection of Angiostrongylus cantonensis larvae from Pomacea canaliculate, with the amin of finding a simple and rapid method suitable for different scenarios.Methods Pomacea canaliculata was caught and collected from ponds, ditches, rivers and other environments in the confirmed epidemic areas reported by predecessors. After each snail was weighed one by one, and dissected into two parts: lung sac and muscle. Firstly, each snail lung sac was check for nodules with lung-microscopy, and the nodules were picked out with anatomical needle and press them separately. Then, the worm was found and identified for worm species under microscope, and the lung sac and snail meat then was rechecked with tissue homogenate.Results A total of 330 snails were detected, with 19.1% (63/330) snails with Angiostrongylus cantonensis stage Ⅲ larvae were detected by tissue homogenate and 15.8% (52/330) snails with nodules were detected by lung-microscopy. Among them, 36 snails with nodules and larvae were detected by the lung-microscopy, and all of them were positive by the tissue homogenate, with a coincidence rate of 100% (36/36); 16 snails with nodules but no larvae, among which 6 snails were positive and 10 snails were negative by the tissue homogenate, The false detection rate was 19.2% (10/52). 278 snails with no nodules, but 21 of them were detected by the tissue homogenate, the missing rate was 7.6% (21/278). There was no significant difference between tissue homogenate and lung-microscopy (taking the positive determination of nodules as the standard) ( χ2=1.27, P=0.26, P>0.05). There was significant difference between tissue homogenate and lung-microscopy (taking the detection of larvae as the standard)( χ2=8.66, P = 0.003, P<0.01). There was no significant difference between the two methods and tissue homogenate in the detection rate of large snails ( ≥25 g, χ2=0.08, P=0.777; χ2=2.58, P=0.108), but there was significant difference between the two methods and tissue homogenate in the detection rate of small snail (≤10 g, χ2=5.63, P=0.02).Conclusions Compared with the tissue homogenate, lung-microscopy is simple in the detection of large snails, requires less instruments and equipment, and its detection speed is faster. It is suitable for the field investigation of the natural focus of Angiostrongylus cantonensis. The tissue homogenate has high sensitivity, can directly display the insect state and activity, has strong insect vitality and high detection rate, it's more suitable for food safety risk monitoring.
广州管圆线虫(Angiostrongylus cantonensis, AC), 其成虫寄生于啮齿动物肺动脉血管内, 第Ⅲ 期幼虫侵入人体中枢神经系统引起嗜酸性粒细胞增多性脑膜脑炎或脑膜炎[1], 称为广州管圆线虫病, 简称“ 酸脑”, 是人类食入含有第Ⅲ 期幼虫的中间宿主或转续宿主导致的一种食源性人兽共患寄生虫病。其中间宿主主要是福寿螺、褐云玛瑙螺和蛞蝓。福寿螺由于分布地域广、个体大捕捞容易, 许多地方除有人食用外, 还敲壳刀切后作为鸡鸭、宠物的饲料, 由于加工的工具和手未及时清洗, 可能有广州管圆线虫幼虫污染, 容易被感染, 已被证实是我国数起广州管圆线虫病集体感染, 引起小范围暴发流行的重要传染源[2, 3, 4, 5], 感染原因皆为在餐馆食用福寿螺引起, 其已成为传播广州管圆线虫的优势中间宿主[6, 7], 在广州管圆线虫病的传播当中扮演着重要角色。寻找快速简便检测福寿螺体内广州管圆线虫的方法是预防广州管圆线虫病的重要手段。检查福寿螺体内广州管圆线虫Ⅲ 期幼虫的方法主要有肺检法、组织匀浆法、胃蛋白酶消化法和PCR法, 后2种方法虽可靠, 但所需仪器和耗材较多, 成本较高, 且耗时费力, 不适合现场大规模普查, 本实验选择简单易操作且易在基层推广的肺检法和直接匀浆法检查福州自然疫源地内福寿螺广州管圆线虫Ⅲ 期幼虫感染情况, 比较两种方法的检出率, 探索快速、准确的检查方法。
在前辈报道已确认的广州管圆线虫自然疫源地的水塘、沟渠、田间垄沟、河流边等适合螺类生长的地方, 捕捞采集福寿螺。
先用肺检法初筛, 然后再把肺囊和螺肉一起用组织匀浆法复检[8]。
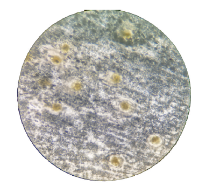
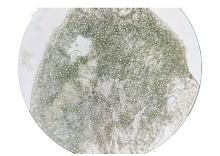
1.2.1 肺检法 每只螺逐只称重后, 将螺用石臼轻敲碎、剔壳, 取出软体, 用清水冲洗软体以去除螺壳碎片及黏液, 用软纱布擦洗掉肺囊外的一层黑膜, 再用眼科小剪刀沿外套膜的左侧至后侧的基部剪开, 将外套膜向右翻开, 取出外套膜后半部分的椭圆形的囊状结构——“ 肺囊”, 将囊袋(双层)沿两边缘剪开, 翻开囊袋呈单层后在载玻片上铺平, 若囊袋层壁较厚, 尽量拉平, 用 2 只注射器针头拨动, 在解剖镜下检查囊壁组织有无幼虫结节。发现结节, 用注射器针头慢慢挑出结节置载玻片上盖上盖玻片用力挤压, 在显微镜下鉴定虫种。肺检法判定标准:以肺囊压片镜检发现结节判定为广州管圆线虫初筛阳性; 以发现结节并在显微镜下发现幼虫且符合广州管圆线虫Ⅲ 期幼虫形态特征者可报告为广州管圆线虫Ⅲ 期幼虫阳性(图1, 图2)。
1.2.2 组织匀浆法 将肺检后的肺囊和剔除胃肠道的软体组织剪成小块置搅拌机或均质器内, 加入少量清水低速搅拌成匀浆, 用20目/吋铜筛过滤去渣, 将滤液置1 000 mL 三角烧杯内, 加入去氯水混匀, 沉淀20~30 min, 再弃去上清液。如此反复清洗, 至上清液透明为止。镜检:将收集的全部沉渣分次倒入培养皿, 在解剖镜下检查, 发现可疑幼虫, 将其吸出, 置载玻片上, 在显微镜下鉴定, 根据其形态特征确定虫种。
广州管圆线虫Ⅲ 期幼虫形态特征:虫体表面具有两层外鞘, 头部钝圆, 尾部末段骤然变细, 大小为(462~526) μ m×(22~27) μ m, 食管、肠管、排泄孔、肛孔及生殖原基清晰可见; 活幼虫运动活泼, 呈S型摆动; 死幼虫颜色发黑, 轮廓模糊, 无蚴体蠕动。如发现幼虫, 经鉴定符合以上特征者, 可报告广州管圆线虫Ⅲ 期幼虫阳性, 并记录虫数, 计算感染率及其感染程度。
用常规方法统计2种方法检查福寿螺广州管圆线虫Ⅲ 期幼虫的检出率。按照公式计算检出率($\mathrm{D}=\frac{H_{m}}{H} \times 100 \% $)、平均感染度($\mathrm{MI}=\frac{N}{H_{m}}$)。Hm为某方法检出感染广州管圆线虫幼虫的福寿螺个体数; H为检测福寿螺总个体数; N为检测获得幼虫数。率间的比较采用χ2检验。P<0.05为差异有统计学意义。
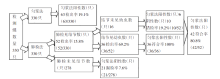
本次实验先后使用肺检法与匀浆法共检查福寿螺330只, 结果见图3。匀浆法与肺检法(以查见结节判定阳性为标准)比较, 两者间检出率差异无统计学意义(χ2=1.27, P>0.05)。匀浆法与肺检法(以查到幼虫判定阳性为标准)比较, 两者间检出率差异有统计学意义 (χ2=8.66, P<0.01)。
肺检法(以查见幼虫判定阳性和以查见结节判定阳性两种判定标准)与匀浆法比较检出情况见表1。结果显示肺检法两种判定方法(检测大螺时)与匀浆法比较其检出率之间差异均无统计学意义(P>0.05); 但在检测小螺方面与匀浆法比较其检出率之间差异均有统计学意义(P<0.05)。
| 表1 不同体质量的福寿螺匀浆法和肺检法广州管圆线虫检出情况 Table 1 The detection of AC in the Pomacea canaliculata with different weight by homogenization and lung-microscopy |
单纯以见到福寿螺肺囊结节为判定阳性检出率15.8%(52/330)和以见到肺囊结节并且从结节查到幼虫为判定阳性检出率10.9%(36/330)两种判定标准比较, 前者虽然检出率高, 但其中有些是假阳性, 假阳性率19.2%(10/52), 检出率两者之间差异无统计学意义(χ2=3.36, P>0.05)。
调查显示体质量越大的螺其感染度越高, 不同体质量的福寿螺其感染度之间差异有统计学意义(χ2=49.4, P<0.001)。见表2。
| 表2 不同体质量的福寿螺广州管圆线虫感染度比较 Table 2 Comparison of infection degree of AC in the Pomacea canaliculata with different weight |
广州管圆线虫在全球的流行都呈现出上升的趋势, 对人类的威胁也越来越大[9]。福寿螺作为外来入侵物种, 约在1981年由南美的巴西经我国台湾省引入大陆[10], 由于其对环境的适应能力和繁殖能力极强, 饲养简单, 迅速扩散至中国南方各省, 2003年中国国家环保总局将福寿螺列为16种危害极大的外来物种之一。因过量繁殖, 也在东南亚各国不断扩散蔓延, 现已成为国际上备受关注的有害生物之一[11]。
福寿螺广州管圆线虫Ⅲ 期幼虫检测法主要有肺检法、直接匀浆法、胃蛋白酶消化法和PCR法。PCR法虽具有极高的灵敏度和特异度, 但该法对操作要求严格, 所需仪器设备昂贵, 成本较高, 适用于实验室研究, 不适用于现场的大批量检测[12]。胃蛋白酶消化法需要胃蛋白酶、浓盐酸, 所需成本比较高, 而且浓盐酸为危化品, 基层疾控中心往往没有储备, 而且不便携带, 动车、汽车均不容许携带, 再者消化需要时间, 比较费时, 需掌握好消化酶的浓度以及消化的时间和强度, 酶浓度过高或时间过长均会影响分离幼虫的活力, 酶浓度过低或消化时间过短时组织消化不完全, 影响检出效率, 该法适用于幼虫的分离和筛选[13]。肺检法主要是以从福寿螺肺囊组织中是否看到幼虫结节来判断是否感染广州管圆线虫Ⅲ 期幼虫, 该方法虽简便、快捷, 但对检测者的知识水平和技术要求较高, 存在检测虫体不直观、易与其他线虫结节混淆及不适合分离幼虫等缺陷[14]。在检测比较大的福寿螺(≥25 g)时, 操作比较方便, 其检出率和准确率比较高和匀浆法相似, 两者之间差异无统计学意义(χ2=0.08, P>0.05); 但在检测比较小的福寿螺(≤10 g)时, 由于小型福寿螺感染率较低[15], 且多为早期感染并且感染度较低, 结节少且较小, 不易看到肺囊结节, 查到幼虫的概率更低, 容易造成漏检和错检; 其检出率和准确率和匀浆法相比, 两者之间差异有统计学意义(χ2= 5.63, P<0.05)。肺检法由于取材局限, 阴性者并不能确定受检螺是否感染, 只作定性检查, 不能确定其感染度; 但与匀浆法相比, 检测螺体内幼虫快速、耗时短, 方法简便, 所需仪器设备更少, 在广州管圆线虫自然疫源地现场大规模螺的普查中值得推广应用[16]。匀浆法和酶消化法是检测、分离收集幼虫比较理想的方法, 具有检测幼虫直观的特点。但直接匀浆法与酶消化法相比, 所需仪器设备及试剂较少, 耗材少成本低, 检测时间更短; 与肺检法相比灵敏度高, 能直观地显示虫态与活度, 虫体活力强, 检出率高, 更适合用于食品安全风险监测中使用。
利益冲突声明 所有作者声明不存在利益冲突
编辑:谢永慧 王思蘅
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|