作者简介:吴慕青(1996—),女,硕士,医师,研究方向:肝脏疾病。
酒精性肝病(alcoholic liver disease, ALD)是全世界最常见的肝脏疾病之一,由于长期酗酒引起肝脏发生一系列病理改变,最终导致肝脏疾病的发生,且发病率逐年上升。目前,酒精性肝病的发生机制及病理研究已经取得了显著进展,但ALD的相关机制并未研究透彻,需要通过改进目前现有的动物模型或建立一种新的更全面的ALD动物模型去模拟人类ALD。ALD的实验动物模型,特别是啮齿类动物,已被广泛用于模拟人类ALD,理想的酒精性肝病啮齿动物模型将有效地模拟酒精对人类肝脏的方方面面。但到目前为止,常用的动物模型都存在一定缺陷,还没有一个完整的动物模型能够模拟人类ALD。本文对ALD发病机制、ALD啮齿动物模型建立的相关方法及其影响因素进行了综述,为相关科研人员建立ALD啮齿动物模型提供理论依据。
Alcoholic liver disease (ALD) is one of the most common liver diseases in the world. Long-term alcoholism causes a series of pathological changes in the liver, which eventually leads to the occurrence of liver diseases with an increasing incidence. At present, significant progress has been made in the pathogenesis and pathological development of alcoholic liver disease, but the relevant mechanism of ALD has not been thoroughly studied. It is necessary to improve the existing animal model or establish a new, more comprehensive animal ALD model to simulate human ALD. Experimental animal models of ALD, especially rodents, are often used to simulate human ALD, and the ideal rodent ALD model can effectively simulate all aspects of alcohol in human liver. But so far, the commonly used animal models all have certain defects, and there is no complete animal model that can simulate human ALD. This paper reviewed the pathogenesis of ALD, related methods and influencing factors of ALD model, and provided a theoretical basis for relevant researchers to establish the ALD rodent model.
酒精性肝病(alcoholic liver disease, ALD)是一种进行性加重的肝脏疾病, 由长期酗酒引起。其病理过程为80%的酗酒者发展为脂肪变性, 35%发展为酒精性肝炎, 10%进展为肝纤维化或肝硬化, 最终发展为终末期肝癌[1, 2]。早期死亡与肝病相关并发症有直接关系[3], 早期的肝炎或肝纤维化可以通过戒酒与药物逆转[4]。大多数情况下, 戒酒可阻止肝脏损伤, 并缓解现有的脂肪变性或炎症, 某些特定的药物能改善ALD的症状和预后, 但晚期肝硬化及肝癌患者暂无特别有效的药物改善, 肝移植及干细胞治疗可能是最后的手段[5], 但其经济负担重, 与之匹配的肝源甚少[6], 不能满足大多数人的需求。流行病学研究表明长期饮酒与患肝癌的优势比(OR)增加约2倍[7]。与全球疾病负担(GBD)研究中的其他危险因素相比, 酒精滥用被列为过早死亡和残疾的第七大主要危险因素[8, 9], 每年约300万人死于酒精相关疾病, 占全球15~49岁人口死亡的近10%[10]。在不同国家, 酒精相关肝硬化的死亡率与人均酒精消费量相关[11]。随着社会发展, 以及我国白酒文化历史源远流长, 除病毒性因素外, 酒精因素引起的疾病逐年增长, 是导致肝脏疾病的第二大原因[11]。
ALD已成为全球健康性问题, 每年因饮酒而死亡人数逐年上升。但酒精性相关肝病的治疗发展却很缓慢, 最主要原因是ALD发病机制不是很清楚, 且机制的研究主要基于动物模型。实验室中常用的动物种类包括啮齿动物(小鼠和大鼠)、斑马鱼、猪、豚鼠、兔子、狗。啮齿动物是最重要的动物模型, 其优点有:(1)抗连续近亲繁殖, 个体(和子代)之间的遗传变异较小; (2)寿命短, 繁殖速度快, 可以更快地积累数据; (3)体积小, 易于操作, 适合大多数实验; (4)成本低, 经济划算[12]。然而, 现有的ALD动物模型存在某些局限性。至今为止, 还没有哪种动物模型能表现出人类ALD的所有主要特征[13]。尽管酒精性肝病动物模型在程度和分期上与人类酒精性肝病的进展存在不可避免的差异。但理想的模型可以通过并改进现有动物模型的方法来模拟人类ALD。寻找理想的ALD实验动物模型, 将有助于ALD发病机制的研究, 为ALD提供新的治疗策略。
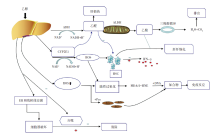
目前, 公认的酒精性肝病的发病机制有多条途径, 最主要的途径是通过肝脏中的乙醇脱氢酶(ADH)来代谢(图1)。当机体摄入一定量的乙醇后, 乙醇经过肝脏(主要)及胃内少部分ADH转化为乙醛(AA), 乙醛是一种具有极强毒性的致癌性物质, 在乙醛脱氢酶(ALDH)的作用下代谢为乙酸, 或直接扩散到细胞间隙中, 从而进入血液。而乙酸进入三羧酸循环后代谢生成能直接排除体外的二氧化碳和水[18, 19]。乙醇氧化代谢成乙醛时, 利用烟酰胺腺嘌呤二核苷酸(NAD+)作为辅因子并产生还原型烟酰胺腺嘌呤二核苷酸(NADH), 从而降低 NAD+与 NADH 的比率, NAD+/NADH是决定肝细胞代谢稳态的关键因素, NAD+/NADH降低后通过减少脂肪酸氧化和增加脂肪酸合成来促进脂肪在肝脏中的积累[20]。此外, 乙醛还能与体内蛋白质结合形成加合物, 通过线粒体中的呼吸链, 使ATP生成减少, 进一步影响其结构和功能改变, 导致肝脏疾病的发生。当人体摄入过量乙醇后, 乙醇通过细胞色素P4502E1(CYP2E1)途径, 并在NADH+H+作用下代谢生成乙醛, 直接激活并诱导肝星状细胞(HSC)产生细胞外基质(ECM), 促进肝纤维化的发生[19]。而活化的HSC被自然杀伤细胞(NK细胞)杀伤后, 产生干扰素-γ (IFN-γ ), 抑制纤维化的发生。当持续饮酒后, NK细胞杀伤能力下降, HSC持续活化, 促进肝纤维化及肝硬化的发生。长期饮酒会使体内氧自由基(ROS)激活, 诱导脂质过氧化, 产生丙二醛(MDA)和4-羟基壬烯醛(4-HNE)等脂质过氧化产物, 并与DNA碱基结合, 产生致癌的DNA加合物, 这些加合物可能作为新抗原发挥作用, 并激活T和B细胞介导的适应性免疫反应, 引起肝损伤[19, 20, 21], 此外, ROS的氧化反应可导致细胞核及线粒体中DNA发生断裂, 以及编码蛋白质功能失调, 而乙醛可通过直接诱导DNA损伤或干扰DNA合成以及削弱参与DNA修复的蛋白质的活性, 若DNA修复受损, 可导致遗传毒性[7, 22]。当ROS与体内蛋白质结合后可产生新的抗原物质, 若进一步与细菌抗原移位, 会诱导宿主发生适应性免疫反应[7, 23]。其次, 乙醇会使内质网(ER)和线粒体应激, 导致细胞器的破坏, 破坏的细胞器可通过自噬来清除, 但在乙醇影响后, 自噬清除能力下降, 细胞器进一步破坏, 肝细胞持续损伤[19]。此外, 乙醇进入体内后, 一部分会使肝细胞释放受损的相关分子模式(DAMP), 另一部分会引起肠道菌群失调, 导致病原相关分子模式(PAMPS), 两者共同作用引起先天免疫反应及炎症[19, 23]。乙醇直接作用于肝细胞, 会使肝细胞产生多种趋化因子, 如肝脏炎症激活Kupffer细胞, 产生大量细胞因子及生长因子, 诱导活化肝星状细胞, 从而引起纤维化发生[24]。
不同的啮齿动物的品系、性别、年龄、酒精摄入剂量、酒精浓度、饮食、环境外在因素、遗传都与酒精性肝病的发展有关。在开始喂养之前, 应该认真考虑这些因素的影响。
大鼠和小鼠的ALD起始和进展在品系间存在差异, 因此在酒精相关研究中选择品系是需要重点考虑因素[25]。啮齿动物天生厌酒, 且对酒精引起的纤维化有一定抵抗作用[26]。啮齿动物的酒精分解代谢速度比人类快5倍, 当血液乙醛水平增加时, 啮齿动物将停止饮酒。与人类相比, 接触酒精后, 这些特征导致啮齿类动物受到的伤害更小。目前最常用的啮齿动物品系有C57BL/6、BALB /C、DBA/2J小鼠、wistar大鼠、SD大鼠以及某些特定的转基因鼠。相对于其他品系而言, C57BL/6天生嗜酒, 是进行酒精喂养的最好品系[27]。最初, 酒精性纤维化模型是在大鼠身上建立的, 后利用小鼠遗传学的优势而广泛应用于小鼠[26]。此外, 研究发现小鼠比大鼠更易发生酒精诱导的ALD[28]。Tsuchiya等[29]采用胃内插管模型的方式对14种近交系的雄性小鼠予以高脂饮食及酒精灌胃[高达27 mg/(kg· d)] 28 d。所有品系在热量摄入量和血液酒精浓度(BAC)相当水平下喂养, 发现NZW/LacJ、C57BL/10J、FVB/NJ、BALB/cByJ品系小鼠表现出严重的肝损伤[29]。这些结果表明, 小鼠对酒精性肝损伤的敏感度有明显的差异, 这与小鼠品系有很强的相关性。且不同遗传背景的近交系小鼠对纤维化损伤具有不同的易感性, 小鼠品系差异会影响纤维化的易感性, 且具有一定器官特异性。例如, C57BL/6J小鼠对肝、肾和心脏纤维化具有抵抗力, 但对肺和肠纤维化易感。然而, BALB/c小鼠对肺纤维化有抵抗力, 但对肝纤维化易感[30]。
除了品系差异外, 酒精因素在性别方面也有一定差异[23, 31, 32]。相对于雄性, 酒精对雌性动物的危害更大[31, 33]。其机制可能涉及雌性动物胃内酒精代谢较低, 以及酒精介导的血清雌二醇水平升高有关[34]。此外, 目前较为推荐体重为超过20 g的8~10周龄雄性小鼠和体重超过19 g的10~12周龄雌性小鼠作为最佳建模对象[15]
目前已有多种酒精性肝病的动物模型, 国内外最常见的几种动物模型如慢性乙醇喂养Lieber-De Carli模型[14]、慢加急性模型 (NIAAA/Gao-Binge模型)[15]、胃内插管模型(Tsukamoto-French)[16]以及二次打击模型如四氯化碳(CCL4)及脂多糖(LPS)等诱导建立的模型[17]。见表1。
| 表1 酒精性肝病常用动物模型特点 Table 1 Characteristics of common animal models of alcoholic liver disease |
啮齿动物自愿饮用含酒精的水(A-DW模型)是建立酒精性肝病最简便的方法, 同时也模仿了人类饮酒的方式及习惯。在人类中, 酒精摄入可以是急性的、短期的[暴饮, (20~50) g/d], 在数小时内一次性摄入, 也可以是长期的(慢性, ≥30 g/d), 持续数年或几十年。A-DW动物模型指在数小时、数天或数周的饮水中添加乙醇, 一般先从5%(v/v)开始, 逐渐增加乙醇10%~40%(v/v), 至小鼠耐受的最高浓度, 同时不限制动物食用标准啮齿类饲料[25]。一般情况下, 口服酒精的啮齿类动物的平均血液酒精浓度(BAC)通常低于150 mg/dL, 长时间喂养会出现轻微的肝脏脂肪变性和炎症, 但不会进展到肝纤维和肝硬化的阶段[25], 短期或长期喂养无死亡率[13]。 如果与含有乙醇的水与酒精脱氢酶抑制剂一起服用, 通过减缓其新陈代谢来提高BAC, 则可以获得更高的BAC。或者, 可以添加香料使酒精味道更好, 来吸引动物主动饮酒。
为了保持饮食控制及克服啮齿动物天生厌酒特性, Lieber和De Carli开发了一种含有乙醇和其他营养成分的液体饮食(L-D)[14]。L-D是一种等热量控制的流质饮食, 其高达36%的热量来自酒精。啮齿类动物除了含有乙醇的液体饲料外, 不给予任何食物和水, 配对喂养的对照组维持热量和营养相当的对照饮食, 其中酒精被麦芽糖糊精所取代。在前1周适应期内, 酒精浓度逐渐升高, 直至适应。通常情况下小鼠平均每天可维持(12~18) g/kg的高酒精摄入量, 比直接在饮用水中添加酒精多2~3倍, 且动物在整个饲养期都保持最高的BAC[35]。该模型可以诱导CYP2E1激活、氧化应激产生、肝脂肪变性、血清转氨基酶轻微升高、肝内甘油三酯升高和肝细胞损伤的早期[36]。因此Lieber-De Carli模型是研究ALD轻度脂肪变性、转氨酶轻度升高和轻微炎症的极佳模型[37]。但是此种模型长期喂养也不会发生肝纤维化及肝硬化。且饲料价格昂贵, 需要每天更换饲料, 对饲养瓶也有一定要求。
为建立更好的ALD动物模型, Gao-binge等在L-D液体酒精饲料的基础上, 开发出一种新的动物模型(NIAAA模型/Gao-Binge模型)。即小鼠接受含有乙醇的液体饲料适应1周, 并在这1周内逐渐增加至5%乙醇浓度, 后继续该浓度的L-D液体酒精饲料喂养10 d, 于第11天清晨7~9点空腹状态下灌胃乙醇(5 g/kg), 9 h后处死[38, 39]。这种方法可以延长8~12周慢性喂养, 并结合每周2~3次灌胃[36]。与L-D模型相比, 可引起更高的BAC, 严重的脂肪变性及肝脏损伤, 炎症细胞浸润。即使延长喂养时间, 也只引起中等程度的酒精性脂肪性肝炎, 没有表现出纤维化及肝硬化[18]。这种模型会导致小鼠体重下降和高死亡率, 长期喂食和多次灌胃乙醇的组合是具有一定挑战性的。
为了克服与口服酒精相关的BAC的局限性, 达到ALD晚期, Tsukamoto和French开发了一种直接胃内插管喂养模型(Tsukamoto-French 模型)[25]。在无菌条件下将导管植入胃内, 酒精被添加到L-D液体饲料或高脂的液体饲料中[37], 并在输液泵的帮助下通过植入的导管直接注入胃内。此模型实现了对营养素或任何液体试验物质的胃内输送的绝对控制。能精确控制喂食量或给药速率(量)和模式(连续、间歇或团注)[16]。这种胃内插管喂养模式的优点是既避开了啮齿动物对酒精的自然厌恶, 也消除了动物饮酒量的障碍, 达到持续的高血液酒精水平。肝损伤和纤维化可在相对较短的时间内重复诱导, 但纤维化程度相当中等, 且不会发生肝硬化[34]。在实际操作中, 该模型仍有些限制。如给药的饮食或物质必须是液体形式, 需要专业操作人员和慢性输液旋转输液设备, 且设备昂贵, 饲养环境要求高, 操作困难, 啮齿动物易感染而死。
为了建成更好的酒精性肝病动物模型, 很多研究者在上述模型的基础上加入不同化学诱导剂, 如四氯化碳(CCl4)[17, 40]、硫代乙酰胺(TAA)、二甲基亚硝胺(DMN)或二乙基亚硝胺(DEN)[40]、脂多糖、吡唑、对乙酰氨基酚(APAP)等化学诱导剂[19, 26], 这种增加诱导剂的方法虽然能更高效地建成研究者所需的各型动物模型。但最终建成的模型往往难以解释是由于酒精因素还是化学诱导剂因素引起的。
3.5.1 四氯化碳(CCl4)诱导模型 四氯化碳(CCl4)是一种应用最广泛的肝毒素诱导剂。可通过腹腔或皮下注射、口服及吸入的方法进入体内[17, 40, 41, 42, 43], 但口服及吸入的方法没有腹腔注射CCl4所诱导的肝纤维化明显, 且时间较长。在最常规造模中, 将CCl4溶于一定比例的橄榄油中, 每周腹腔注射2~3次, 剂量范围为(300~1 000)μ L/kg, 同时也有研究报道C57BL/6小鼠模型通过腹腔注射剂量为(0.5~0.7) μ L/g的CCl4, 2次/周, 共6周, 或3次/周, 共4周, 可明显诱导肝纤维化[44]。CCl4(750 mL/kg, 2次/周, 共9周)诱导的Sprague-Dawley大鼠出现严重的纤维化。皮下注射能降低小鼠死亡率, 但在注射部位会长出肉芽肿。吸入的方法仍有一定局限, 如对设备的要求以及相关人员培训等。目前, 口服CCl4的方法仍有很大争议。CCl4诱导肝脏生物转化依赖于CYP2E1途径, 促进自由基反应和脂质过氧化。因此, 可诱导小叶中央坏死, 炎症细胞聚集, 胶原纤维的产生及细胞外基质被激活, 肝星状细胞激活后导致肝纤维化及肝硬化[45]。
3.5.2 其他化学诱导模型 除了CCl4诱导外, 硫代乙酰胺(TAA)是仅次于CCl4的肝毒素诱导的第二大模型, 同样也可通过腹腔注射、口服进入体内。腹腔注射TAA的方式是将TAA溶解在生理盐水中(剂量根据体重进行调整)再进行注射。关于使用TAA 诱导肝硬化的方案有多种, Boyer-Diaz等[46]使用SD大鼠, 通过腹腔注射TAA溶液(250 mg/kg), 在12 周内建立进展期慢性肝病模型。Uehara等[40]使用二乙基亚硝胺(DEN)联合四氯化碳诱导小鼠晚期肝硬化及肝癌的动物模型。LU等[47]联合使用CYP2E1诱导剂吡唑及脂多糖(LPS), 建立LPS/吡唑协同毒性小鼠模型, 表明了CYP2E1可增强LPS诱导肝损伤。
转基因模型已经被用来评估特定因素在纤维化形成中的作用。一般说来, 基因敲除鼠(KO)中纤维化的增加(或减少)与野生(WT)组相比, 自发的或对促纤维化刺激的反应, 将表明该基因产物直接或间接地发挥抗纤维化(或促纤维化)的特性。众所周知, 在饮酒过程中, CYP2E1及ALDH2与ALD的氧化应激、DNA损伤有关, ALDH2缺乏会引起过量的乙醛积聚和氧化应激, 导致线粒体DNA损伤。Seo等[48]使用C57BL/6N背景下ALDH2全基因敲除(Aldh2Hep-/-)建立酒精相关性肝癌。Kwon等[49]发现乙醛脱氢酶2敲除小鼠可改善酒精性脂肪肝但加重肝脏炎症和纤维化。CYP2E1过表达的小鼠增加ALD的严重程度, 在CYP2E1缺失的小鼠可减轻ALD的严重程度。如Lu等[47]使用CYP2E1敲除小鼠的研究表明乙醇具有一定毒性且能加重小鼠肝脏的损伤程度。Zhou等[50]用肠道特异性SIRT1缺失基因敲除小鼠表明肠道SIRT1对酒精性肝损伤具有不利影响。Xu等[51]给予脂肪特异性蛋白27转基因小鼠(Fsp27Hep-/-)5%乙醇液体饲料喂养, 并联合多次灌胃, 结果表明FSP27的过表达与乙醇暴露对小鼠肝细胞线粒体活性氧的产生和肝细胞的损伤具有协同作用。酒精通过解除对肝脏miRNAs的调控, 影响参与不同细胞功能的蛋白质的表达。如在miR-155敲除的小鼠模型显示, 慢性酒精灌胃后, 肠道炎症减轻, 血清中LPS增加, 促炎细胞因子减少, 肝脏损伤和纤维化减轻[52]。巨噬细胞与酒精相关的脂多糖高反应性与miR-155介导的Toll样受体(TLR)信号负调控因子的表达减少, 而抑制miR-122基因可加速酒精引起的肝损伤, 如在酒精性肝硬化患者及酒精喂养的小鼠中miR-122表达明显降低[19, 22]。越来越多的证据表明, 在不久的将来, 转基因背景的啮齿动物会越来越丰富, 可能成为探索ALD新机制的宝贵工具。
目前已建立了多种啮齿动物ALD模型用于ALD机制的研究和潜在药物的评价。然而, 所有的ALD模型都存在缺陷。如Liber-De Carli液体饮食模型方便、易处理, 适用于大多数实验室; NIAAA模型可以模拟人类ALD的“ 慢加急性” 模式, 在这些模型中仅使用乙醇后, 啮齿动物的主要变化仅限于肝脏脂肪变性, 诱导ALD的早期阶段, 即使长期喂养也是如此。尽管Tsukamoto-France模型会导致更高BAC、中等程度的肝纤维化, 但并不适合人类自愿饮酒模式, 且操作困难、设备昂贵。若需建立更严重的肝纤维化、肝硬化甚至肝癌的动物模型, 往往需要“ 二次打击”, 加上化学诱导剂来建立, 这种模型建立成功后所观察到的各种分子和细胞机制不能直接归因于酒精本身。此外, 由于啮齿动物和人类在生理和病理上存在明显的物种差异, 将大鼠或小鼠的研究结果转化为人类是有问题的。我们团队也使用Gao-binge模型建立酒精性肝病动物模型, 喂养时间长达12周以上, 遗憾的是, 小鼠仅表现出中度的炎症反应和脂肪变性, 无肝纤维化的发生。寻找好的方法建立单纯性酒精性肝纤维化或肝硬化的动物模型迫在眉睫, 随着相关技术的发展, 在未来, 一些转基因动物模型可能会发挥出更强大的作用。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
更正声明
本刊2022年第22卷第8期744页刊登的《江苏省无锡市2018—2020年学生肺结核疫情流行特征》一文基金项目中“ 无锡市科技发展医疗卫生指导性计划项目” 有误, 应为“ 2020年无锡市科技发展医疗卫生指导性计划项目” 。
特此更正
《中国热带医学》编辑部
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|