作者简介:单琨(1983—),女,本科,主管检验师,研究方向:病原菌分离与鉴定。左惠芬(1982—),女,本科,副主任检验师,研究方向:病原菌分离与鉴定。
#左惠芬同为第一作者
分析在1例肝硬化脾切除术后患者被新型隐球菌侵入血流引起播散性隐球菌病的临床表现、治疗措施与实验室检测结果。患者,男性,30岁,于2016年3月因“脾大、脾功能亢进”行“脾切除+贲门周围血管离断术”,术后多次无明显诱因发热,体温最高39 ℃,相继伴背痛、左下肢脓肿和右髋关节痛。CT和MRI显示患者肺部病变及多处骨质破坏,期间抗生素治疗效果不佳。2017年4月19日对脓液直接革兰染色、墨汁染色,使用API 32C、Vitek 2 Compact、rDNA ITS和IGS序列分析等方法对分离自患者脓液、血液中的菌株进行鉴定,检测患者血清中隐球菌抗原,使用ATB FUNGUS 3进行抗真菌药敏试验。结果在新鲜脓液标本墨汁染色后菌株呈现厚厚的荚膜,从脓液及血液中分离出的菌株经API 32C、Vitek 2 Compact、rDNA ITS和IGS序列分析均鉴定该菌为新型隐球菌,血清新型隐球菌荚膜抗原阳性。该菌对5-氟胞嘧啶、两性霉素B、氟康唑、伊曲康唑及伏立康唑的最小抑菌浓度分别为:<4 mg/L、<0.5 mg/L、4 mg/L、≤0.25 mg/L和0.125 mg/L。给予“氟康唑联合两性霉素B”抗感染治疗2个月脓肿缩小,6个月患者康复。隐球菌感染起病隐匿且临床症状不典型,缺乏特异性,经血流播散造成血流感染会累及包括皮肤、骨骼等全身多个脏器。临床应尽早采血培养监测,去除原发病灶以切断感染途径并进行有效抗隐球菌治疗。
To analyze the clinical, therapeutic and laboratory characteristics of disseminated cryptococcosis caused by Cryptococcus neoformans invading the blood stream in patient with liver cirrhosis and splenectomy. A 30-year-old male underwent splenectomy plus pericardial devascularization due to "splenomegaly and hypersplenism" in March in 2016. The patient had intermittent fever after operation for many times, and successively accompanied with back pain, left lower limb abscess and right hip pain. The highest body temperature was 39 ℃. CT and MRI revealed the lung lesion and multiple bone destruction. During that period, the effect of antibiotics was not good. On April 19th, 2017, Gram's stain, India ink stain, API 32C, Vitek 2 Compact, ribosomal ITS and IGS sequence analysis were performed to identify the strain isolated from the pus and blood stream. The serum of the patient was detected for cryptococcal antigen. Antifungal susceptibility test was used to determine drug sensitivity and minimum inhibitory concentration (MIC). The Cryptococcus neoformans isolated from fresh pus specimen showed a prominent, thick capsule after India ink stain. The colonies isolated from pus and blood stream were identified Cryptococcus neoformans using API 32C, Vitek 2 Compact, and sequence analysis of rDNA ITS and IGS. Cryptococcal capsule antigen was positive. The minimal inhibitory concentrations of 5-Flucytosine, amphotericin B, fluconazole, itriconazole, voriconazole against the isolate were <4 μg/mL, <0.5 μg/mL, 4 μg/mL, ≤0.25 μg/mL, 0.125 μg/mL respectively. The patient was initially treated with intravenous amphotericin B and flucytosine. After anti-Cryptococcus treatment for two months, the patient clinically improved, and the lesions were reduced on a follow-up CT scan. The patient made a full functional recovery after treatment for six months. Cryptococcosis has hidden onset, atypical clinical symptoms and lack of specificity. Blood stream is the main channel for Cryptococcus to spread and involve many organs of the whole body, including skin, bone and so on. Therefore, early use of blood culture to monitor blood flow dissemination, actively removing the primary focus and cutting off the infection route in time and carrying out effective anti- Cryptococcus treatment are conducive to the patient's early recovery.
近年来隐球菌感染日益受到重视, 其中, 新型隐球菌因其菌体外层宽厚的多糖荚膜上含有其最主要的毒力因子— — 葡糖醛木苷聚糖而成为对人类致病的最主要菌种, 且大多经呼吸道吸入, 在肺内引起轻度炎症或隐性感染, 当机体抵抗力降低时, 可向全身扩散。新型隐球菌扩散后, 通常最易侵犯的是中枢神经系统, 引起慢性脑膜炎。此外, 还可引起肺隐球菌病(支气管肺炎), 但骨骼受累较为少见[1, 2, 3], 本文报道新型隐球菌在肝硬化脾切除术后患者侵入血流引起血流感染, 进而造成肺部、皮肤及骨骼多灶播散性隐球菌病的病例, 结合相关文献, 对患者的临床表现、影像学特点、实验室对该隐球菌的鉴定进行分析和讨论, 旨在为今后临床诊治隐球菌病提供经验和帮助。
患者男性, 30岁, 2006年发现乙肝大三阳、HBV DNA(+), 诊断为“ 慢性乙型肝炎” 。2014年1月出现厌油、纳差、腹胀, 实验室查血常规示白细胞计数(WBC)和血小板计数(PLT)减少, 肝功能异常, HBV DNA 2.92× 107copies/mL; 腹部CT示肝硬化, 脾大, 腹水。诊断为“ 乙肝肝硬化失代偿期” 。给予保肝、抗病毒等治疗后病情好转。2016年3月因脾大、脾亢行“ 脾切除+贲门周围血管离断术” , 术后开始间断发热, 最高39 ℃, 2016年11月底出现右髋关节痛, MRI示右侧部分髋臼-坐骨结节-部分耻骨下支信号异常。背部脓肿分泌物培养示耐甲氧西林金黄色葡萄球菌(MRSA)。使用头孢曲松治疗效果不佳。2016年12月底胸部CT示胸8、9左侧椎体、附件及局部肋骨骨质破坏及局部软组织增厚、密度不均, 肺结节穿刺培养提示有MRSA生长, 给予“ 替考拉宁、万古霉素、阿米卡星” 等治疗无效, 2017年1月26日入住河北医科大学第三医院感染科。
入院检查:白细胞计数(WBC)8.48× 109/L、中性粒细胞比例(NEUT%)为 63.90%、红细胞计数(RBC)4.65× 1012/L、血红蛋白(HGB)114.40 g/L、PLT 859.00× 109/L; 降钙素原(PCT) 0.01 mg/L; 红细胞沉降率(ESR) 75 mm/h; C反应蛋白(CRP) 68.4 mg/L; T细胞亚群:CD3+ 86.04%、CD4+ 29.55%、CD8+ 48.41% 、CD4+/CD8+0.61, 骨髓象提示感染性骨髓象。住院后近2个月期间多次复查血常规及炎症指标, 炎症指标未见回落, 序贯升级抗生素治疗(替加环素及依替米星、利奈唑胺联合阿米卡星、万古霉素联合克林霉素、达托霉素)无明显疗效。2017年4月19日因在脓液中检出新型隐球菌, 诊断为播散性隐球菌病。给予抗隐球菌治疗后患者康复, 未再复发。
1.2.1 样本采集
4月19日将患者右侧背部脓肿穿刺液、右臀部脓肿穿刺液接种血琼脂平板和中国蓝平板、在BacT/ALERT需氧培养瓶中进行培养, 同时抽血进行血液细菌、真菌培养。
1.2.2 微生物常规鉴定
对脓液革兰染色、墨汁染色, 将分离自患者脓液、血液中的隐球菌分别接种于 Chromagar 显色培养基、血平板培养基35 ℃培养, 使用API 32C、全自动微生物鉴定仪Vitek 2 Compact对该菌进行菌种鉴定。同时对患者血清及脑脊液进行隐球菌荚膜多糖抗原检测。
1.2.3 基因鉴定
rDNA ITS和 IGS序列分析参照 Meyer等[4]方法提取基因组 DNA。用真菌通用引物分别扩增其 rDNA ITS区和 IGS 区, PCR反应条件见参考文献[5]。PCR 扩增产物送北京睿博兴科生物技术有限公司双向测序。原始序列与其序列彩图对比、分析并拼接后进入GenBank 进行同源序列搜索(http://blast.ncbi.nlm.nih.gov/Blast.cgi)。
1.2.4 抗真菌药敏实验
使用ATB FUNGUS 3对该菌进行抗真菌药敏试验, 测试其对 5-氟胞嘧啶、两性霉素 B、氟康唑、伊曲康唑、伏立康唑的最小抑菌浓度(MIC)
1.2.5 CT和MRI用于显示患者肺部病变及多处骨质破坏。
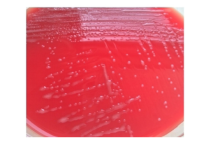
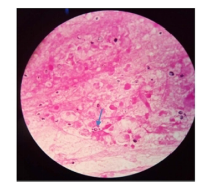
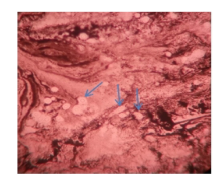
脓肿穿刺液革兰染色病原菌荚膜稍明显、未着色(透明光晕), 内有芽生孢子, 墨汁染色病原菌外层的光晕为厚厚的荚膜, 荚膜包裹着菌细胞, 提示可能是隐球菌(图1~图2)。患者血清隐球菌荚膜多糖抗原滴度为1∶ 1 024。背部及右臀部脓肿穿刺液直接接种血平板, 5 d后培养物由最初的白色逐渐转淡黄或棕黄、湿润粘稠, 状似胶汁(图3)。血液在BacT/ALERT需氧培养瓶中培养5 d后转种血平板, 5 d后生长的菌落形态与脓肿穿刺液一致。脑脊液墨汁染色、隐球菌荚膜多糖抗原及脑脊液培养均阴性。ID32 C和Vitek 2 Compact生化鉴定上述纯培养菌落, 结果为新型隐球菌(Cryptococcus neoformans), 鉴定率=99.9%, 符合率为T=0.84。
 | 图1 脓汁革兰染色(× 1 000) 箭头所指为新型隐球菌。Fig.1 Gram staining of pus (× 1 000) Cryptococcus neoformans is showed by arrow. |
 | 图2 脓汁墨汁染色(× 1 000) 箭头所指为新型隐球菌。Fig.2 Ink staining of pus (× 1 000) Cryptococcus neoformans is showed by arrows. |
将该菌株序列上传至GenBank数据库, rDNA ITS、IGS序列经NCBI BLAST数据库比对, 与新型隐球菌有100%同源性(GenBank编号:CP003821.1), 报告为新型隐球菌。与此同时, 将该病例分离的这株新型隐球菌的序列(SUB2873857 Seq1)存放于GenBank数据库中, 登录号为MF490470。
对5-氟胞嘧啶、两性霉素B、氟康唑、伊曲康唑及伏立康唑MIC分别为 < 4 mg/L、 < 0.5 mg/L、4 mg/L、≤ 0.25 mg/L和0.125 mg/L。
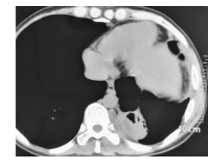
2016年12月28日发现患者左侧胸膜肥厚。左肺下叶后基底段肿块内出现低密度脓腔, 中心部位液化坏死, 左侧椎旁软组织增厚(图4), 颅脑CT平扫未见明确异常表现。综合上述结果, 修正诊断为播散性隐球菌病。2017年4月20日起给予“ 氟康唑0.4 g 1次/d联合两性霉素B” 抗感染治疗, 两性霉素B首剂0.1 mg/(kg• d), 之后每日增加5 mg, 维持量0.5 mg/(kg• d)(约25 mg), 氟康唑:400 mg 1次/d。经上述治疗, 2个月后患者体温降至正常, 右肩胛部切口逐渐愈合, 背部脓肿消失, 右臀部脓肿缩小, WBC、NE、ESR及CRP降至正常, 2017年6月16日复查CT显示左下肺肿块由原来的6.2 cm× 5.1 cm减小为 4.4 cm× 1.7 cm, 右侧坐骨、右侧肩胛骨尖峰基底段周围软组织肿胀明显较前减小。治疗6个月后, 患者康复, 至今无复发。
隐球菌感染骨骼受累较为少见, 查阅文献发现骨骼受累通常会发生在椎骨, 其余部位分别是肋骨、胫骨、股骨、髌骨等[6, 7, 8], 本例患者新型隐球菌侵犯的是椎骨、肋骨、坐骨以及肩胛骨。依据本例患者就诊经历, 肝硬化脾切除术后间断发热近1年, 推测患者最初就已经存在肺部新型隐球菌隐性感染, 脾切除术后免疫功能低下, 来源于肺部的新型隐球菌开始发生血行播散, 陆续出现背部、左下肢出现脓肿, 右髋关节痛, 8个月后CT检查发现存在肺脓肿, 左侧第9、10后肋、第10胸椎及左侧横突多发骨质破坏, 至此时已演变成播散性隐球菌病。2016年11月底背部脓肿分泌物培养出耐甲氧西林金黄色葡萄球菌(MRSA), 推测患者此时可能存在新型隐球菌和MRSA的混合感染, 此时隐球菌培养阴性的可能原因是部分实验室分泌物只培养48 h即结束, 而当新型隐球菌感染菌量极少的情况下, 有可能3 d才稍有肉眼可见菌落。另外脓液涂片镜检通常因为病原少或着色不良而无阳性发现, 需有经验的资深临床微生物专家才能进行识别。2016年12月底肺结节穿刺培养依然是MRSA, 隐球菌培养仍为阴性。事实上, 根据血液培养技术用于血流感染诊断临床实践专家共识及相关文献, 持续不断的不明原因发热恰恰是血培养的适应症[9, 10, 11], 上述多个时间节点正是进行血培养查找病原菌的有利时机。后期血培养只检出隐球菌, 再次说明之前背部脓肿分泌物、肺结节穿刺培养出的MRSA并无入血形成血流播散(即MRSA仅导致局部感染), 新型隐球菌才是导致该患者历时一年多播散性皮肤、骨骼多灶性及肺部感染病程真正的“ 罪魁祸首” 。
本例患者脓液的直接墨汁染色之于隐球菌的识别和辨认, 既简便又有效, 彰显“ 涂片找” 非常重要[12, 13]; 综合运用基本的培养技术、形态学识别、抗原检测与核酸分子测序鉴定技术有助于精准锁定一些特殊病原菌[14], 本病例最终锁定为播散性隐球菌病。隐球菌病起病隐匿, 血培养是监测隐球菌血流播散的有效手段, 能够助力该病的正确诊断和及时处理, 有效避免因处理不当而造成的进一步的播散, 极大提高隐球菌病的治愈率。
志谢 衷心感谢卫生部北京医院陈东科老师、广东省中医院屈平华老师及江西省人民医院陈会老师在本研究过程中的大力帮助和支持
利益冲突声明 所有作者声明不存在利益冲突
编辑:符式刚
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|