作者简介:梁婉欣(1995–),女,在读硕士,研究方向:抗新冠病毒感染的靶向药物。
目的 探讨巴瑞替尼在新型冠状病毒感染中的抗病毒作用及对细胞因子表达的影响。方法 首先使用SARS-CoV-2 (MOI=0.1)感染Calu-3 细胞系,通过RT-qPCR分析新冠病毒感染过程中炎症因子(IL-6、IL-8、TNF-α和IL-1β)、干扰素β(IFN-β)和干扰素刺激基因(IFIT2)mRNA表达水平。下一步用巴瑞替尼预处理Calu-3细胞2 h,之后感染SARS-CoV-2 (MOI=0.1),分别在感染后0、24、36、48 h时间点收集细胞,比较药物处理组和未处理组中上述基因mRNA表达水平及对病毒复制的影响作用。结果 SARS-CoV-2感染Calu-3细胞后,可诱导促炎因子(IL-6、TNF-a、IL-1β)和干扰素及干扰素刺激因子(IFN-β和IFIT2)mRNA水平发生不同程度的显著上调,病毒感染组在感染48 h相对于未感染组上调了近100倍或以上( P<0.000 1),上述因子的mRNA表达水平随感染时间延长持续增加( P<0.001或 P<0.000 1)。IL-8 mRNA水平上升幅度尽管无上述基因显著,但也呈现2~4倍的增加。巴瑞替尼预处理Calu-3细胞后,对胞内SARS-CoV-2的复制水平无显著抑制作用( P>0.05)。然而,该药物可显著抑制SARS-CoV-2感染诱导的IL-6和TNF-α水平的上调(分别下调5.25倍和3.90倍, P<0.01),对IL-8和IL-1β的水平影响不大。另外,该药物也可明显下调病毒感染对IFN-β和IFIT2水平的增加(分别下调10.51倍和90.78倍, P<0.000 1)。结果 巴瑞替尼药物尽管对新冠病毒在细胞内病毒载量水平无显著抑制效应,但可不同程度抑制新冠病毒感染诱导的炎症因子的大量释放,尤其对干扰素和干扰素刺激基因表达的抑制作用更加显著。考虑到IFN-Ⅰ反应在病毒感染过程中发挥重要作用,临床必须谨慎使用巴瑞替尼治疗 COVID-19 患者。
Objective To explore the antiviral effect of baricitinib in the SARS-CoV-2 infection and influence on cytokine levels.Methods Calu-3 cells were infected with SARS-CoV-2 at MOI of 0.1, and the levels of inflammatory cytokines (IL-6, IL-8, TNF-α and IL-1β), interferon β (IFN-β) and interferon-stimulated gene, IFIT2 in the infected cells were analyzed by qRT-PCR methods. At the same time, Calu-3 cells were infected with SARS-CoV-2 (MOI=0.1) after being treated with baricitinib for 2 hours. Cells were collected at 0, 24, 36, and 48 hours, and analyzed for the mRNA of the above genes in the drug-treated and untreated groups.Results The mRNA levels of IL-6, TNF-a, IL-1β, IFN-β and IFIT2 in Calu-3 infected by SARS-CoV-2 cells were increased significantly. These cytokines were increased by nearly 100-fold post-infection 48 h compared with the control ( P<0.000 1), and continued to increase with the infection time ( P<0.001 or P<0.000 1). The increase of IL-8 mRNA level was not as significant as IL-6, TNF-α, IL-8, IL-1β, but it also showed a 2-4 folds increase. Baricitinib does not affect the level of viral RNA in Calu-3 cells after SARS-CoV-2 infection ( P>0.05). However, baricitinib can significantly inhibit the up-regulation of IL-6 and TNF-α levels induced by SARS-CoV-2 infection (5.25-fold and 3.90-fold down-regulation, respectively, P<0.01), and has little effect on the levels of IL-8 and IL-1β . In addition, the drug could also significantly down-regulate the increase in IFN-β and IFIT2 levels caused by viral infection (10.51-fold and 90.78-fold down-regulation, respectively, P<0.000 1).Conclusions Baricitinib inhibits the release of inflammatory cytokines to some extent, but it drastically down-regulates the expression of interferons and interferon-stimulated genes (ISGs), and has limited antiviral effect on SARS-CoV-2. Considering that interferon signal pathways play important roles on viral infection, caution should be exercised when using baricitinib to treat COVID-19 patients.
近期由新型冠状病毒(SARS-CoV-2)感染引起的新型冠状病毒肺炎(coronavirus disease 2019 , COVID-19)引起了全世界的大流行, 已给全社会乃至全球带来严重的经济负担。研究发现该病毒主要通过识别细胞表面的ACE2受体介导感染[1]。COVID-19临床特征表现为:发病后1~2周左右病情加重; 淋巴细胞水平下降, 尤其是外周血中的自然杀伤(NK)细胞; 促炎细胞因子和 C 反应蛋白 (CRP)显著升高。据统计约15.7%的患者会发展成重症肺炎, 其中细胞因子风暴是导致病情快速加重的重要因素[2, 3]。当前发展有效的抗病毒药物用于预防或治疗新冠肺炎病情的发展显得十分紧迫。
巴瑞替尼(Baricitinib)作为一种免疫抑制剂, 可通过抑制 Janus 激酶活性(JAK1 或 JAK2)降低炎症因子的表达, 已被美国FDA批准应用于临床类风湿性关节炎(RA)的治疗[4, 5]。新冠疫情暴发早期, 针对重症新冠肺炎患者, 过激的炎症因子对机体各种组织器官造成明显损伤, 因此, 临床上尝试用该药物联合抗病毒药一起治疗重症新冠肺炎患者。据出院情况统计, 该药物的确可以降低炎症因子的水平, 减轻病理进程, 缩短患者的恢复期。然而, 也有专家提出质疑, 由于该药物是JAK激酶抑制剂, 不具有靶向特异性, 不仅能影响促炎因子的表达, 同时也可能会抑制干扰素信号通路相关基因的表达, 影响宿主自身的抗病毒反应。因此, 本文从细胞学角度, 探讨该药物对病毒复制、炎症因子及干扰素信号通路相关基因表达的影响, 确立该药物在新冠感染过程中的作用, 论证一些专家评论对该药物的质疑和猜测。
细胞培养所用试剂[MEM和DMEM培养基、胎牛血清(FBS)、胰酶、100× Hepes等]均购自于GIBCO公司。总RNA提取试剂盒I(R6834-02)购自于Omega公司; 病毒RNA抽提试剂盒(52906)购自Qiaqen公司。逆转录试剂及Taq聚合酶购自TaKaRa公司。
Vero-E6 -和Calu-3 细胞由深圳市第三人民医院张国良课题组保存。Calu-3 细胞培养条件为:含有 10% FBS、1% PS 和非必需氨基酸的 MEM 培养基。该细胞细胞每2~3天换液, 长满后按照1∶ 3比例传代。Vero-E6细胞培养条件为:含有 10% FBS、1% PS 和1× Hepes的高糖DMEM 培养基; 细胞约48 h传代1次, 1∶ 4~6进行传代。
新冠病毒武汉株(命名为SARS-CoV-2 YCJ-P3)由深圳市第三人民医院生物安全三级实验室分离保存。扩毒前一天将Vero-E6 细胞铺成单层, 接种病毒前细胞密度达到75%~80%。接种病毒, 每天观察细胞病变(CPE)。待细胞病变达到80%以上, 收集病毒上清, 离心去除细胞碎片进行等体积分装, -80 ℃保存。冻存后病毒利用TCID50法进行滴度测定。
消化Calu-3细胞铺板成单层细胞, 使用不同浓度巴瑞替尼预处理细胞2 h, 以二甲基亚砜(DMSO)为对照组, 然后加入 MOI=0.1 SARS-CoV-2进行感染。病毒吸附后PBS洗2遍, 加含相同药物浓度的培养基继续培养。分别在感染24 h和48 h观察CPE, 确立药物有效保护浓度范围。选择10 μ mol/L作为后续研究, 分别在指定感染点收集上清和细胞, 用于总RNA的提取。用培养基将巴瑞替尼从100 μ mol/L作3倍比稀释, 然后加入Calu-3细胞中。分别在药物作用不同时间点加入CCK-8试剂, 检测细胞的增殖情况。
根据细胞和病毒总RNA提取试剂盒说明书提取总 RNA, 方案按照说明书进行。使用Takman探针法定量病毒RNA水平; 细胞基因和病毒RNA水平采用SYBR Green染料法作定量分析。其中, 以GAPDH作为内参基因。基因的qPCR引物序列详见表1。
| 表1 RT-qPCR引物序列 Table 1 The sequences of RT-qPCR primer |
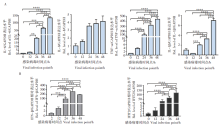
前期实验以不同MOI(0.01、0.05和0.1)的 SARS-CoV-2感染Calu-3 细胞, 结果显示在 MOI 为 0.1 时可诱发明显的细胞病变效应 (CPE)。之后, 以MOI 0.1感染Calu-3细胞, 在不同感染时间点收集细胞, 提取细胞总RNA, 通过RT-qPCR方法分析新冠病毒感染引起Calu-3细胞内炎症因子(IL-6、IL-8、TNF-α 和IL-1β )和干扰素相关因子(IFN-β 和IFIT2)的表达水平。结果表明, 上述因子mRNA表达水平随SARS-CoV-2感染时间延长而发生不同程度地升高, 在病毒感染48 h, IL-6、TNF-α 的水平相对于感染前升高了100~400倍, IL-8和IL-1β 水平增加了3~7倍(图1A), 干扰素及干扰素刺激因子IFN-β 和IFIT2的水平增加了100~300倍(图1B)。这说明SARS-CoV-2感染可诱导机体产生强的炎症反应和免疫应答反应。
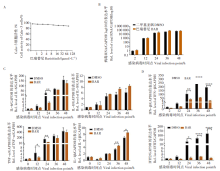
使用不同浓度的巴瑞替尼与Calu-3细胞共孵育, 在孵育48 h借助CCK-8 试剂测定该药物对细胞活性的影响。结果显示在药物浓度100 μ mol/L时, 该药对 Calu-3 细胞毒性仅10%左右(图 2A), 说明该药物对细胞低毒。因此, 我们借鉴文献中推荐的10 μ mol/L测试该药物对新冠病毒的抑制作用。通过检测该药物处理组在不同感染时间点胞内病毒RNA水平, 发现巴瑞替尼不能显著抑制Calu-3 胞内病毒 RNA 水平(图 2B), 即不影响胞内病毒的复制。
实验结果表明(图2C), 该药物在10 μ mol/L浓度条件下, 可显著下调IL-6和TNF-α 的水平(分别下调5.25倍和3.90倍, P< 0.01), 对IL-8的水平影响不大(P> 0.05), 对IL-1β 有一定的促进作用(P< 0.01)。另外该药物在病毒感染24 h后对IFN-β 和IFIT2的降低水平可达到几十上百倍(图2D, P< 0.01或P< 0.000 1)。上述结果说明巴瑞替尼不仅下调促炎因子的表达, 也抑制抗病毒因子Ⅰ -IFN及ISGs基因的表达。
新型冠状病毒感染宿主细胞后可诱导严重的炎症反应并且发展为重症肺炎, 炎症因子风暴是诱导重症肺炎的主要因素[2, 3]。本文的研究结果也发现促炎因子IL-6、TNF-α 、IL-8、IL-1β 等也发生不同程度的显著上调, 与已有的报道[2, 3]相一致。然而目前暂未发现针对新冠肺炎临床治疗的特效药。为控制当前新冠疫情, 多种药物正进入临床试验阶段。例如甲磺酸萘莫司他和磷酸氯喹[7]分别通过抑制TMPRSS2 蛋白酶活性和ACE2 受体的末端磷酸化达到抑制SARS-CoV-2进入宿主细胞的效果; 瑞德西韦[7]和莫努匹韦[8]等药物可通过干扰病毒 RNA 依赖性 RNA 聚合酶 (RdRp)合成抑制病毒复制。除此以外, 木犀草素、槲皮素、山奈酚等[7]黄酮类化合物被报道可干扰NLRP3 炎性体的激活从而调节β 冠状病毒引起的炎症反应, 有望被应用于新冠肺炎临床治疗。
巴瑞替尼作为一种FDA已审批的抗风湿性关节炎药物, 主要是可抑制炎症因子的大量释放。研究表明该药物是一种选择性和可逆的Janus激酶(JaK1和Jak2)抑制剂, 这两种激酶都可启动以IL-6为代表的炎症因子与其受体结合引起的信号转导[6]。巴瑞替尼首次被提出用于治疗 COVID-19 疾病, 是由于其可以抑制炎性细胞因子的表达, 减少氧疗的需要, 并逐渐增加 P/F(PaO2, 氧分压/ FiO2, 吸入氧)的分数比率[9]。本文的研究结果也表明该药物可显著下调新冠病毒感染引起的IL-6、TNF-α 的水平, 但对IL-8及IL-1β 没有抑制效应, 可能通过不同的通路影响炎症因子的表达。
已知Baricitinib可通过抑制 Janus 激酶活性(JAK1 或 JAK2)降低炎症因子的表达[6]。本文借助RT-qPCR技术, 通过检测不同感染时间点该药物处理组内上述炎症因子和干扰素及下游ISGs的mRNA水平, 探讨巴瑞替尼是否可抑制新冠病毒感染过程中炎症因子和干扰素及ISGs基因的表达。由于该药物不具有靶向特异性, 不仅可抑制炎症因子的表达, 也可通过JAK/STAT通路抑制Ⅰ 型干扰素信号通路, 进而影响下游干扰素相关因子的表达[10, 11]。已有的研究[12]表明, 先天免疫细胞(如巨噬细胞、树突细胞等)模式识别受体分子接触到病毒特异抗原物质(DNA, RNA)后, 可通过激活胞内信号, 启动Ⅰ 型干扰素(IFN-α 、β )的表达。Ⅰ 型干扰素是一种分泌性蛋白, 会与膜上的Ⅰ 型干扰素受体分子结合, 激活JAK1/STAT信号, 进入细胞核内协助IRF9转录激活干扰素下游相关因子的表达[12]。Ⅰ 型干扰素的抗病毒保护效应主要是通过促进下游一些ISGs的表达, 进而抑制病毒的复制[13]。研究报道, Baricitinib可通过抑制JAK1/STAT信号通路, 影响下游ISGs因子的表达, 其中包括识别SARS-CoV-2刺突蛋白的ACE2受体分子, 该分子的表达水平直接影响病毒的胞内复制[14]。另外, Ⅰ 型干扰素还可以促进树突细胞的活化, 提高细胞表面MHC-Ⅱ 与辅助刺激因子CD80、CD86的表达, 增强APC细胞的抗原递呈能力[15]; 还有研究表明其可直接作用于T细胞和B细胞, 提高其活化水平发挥抗病毒效应[16, 17]。
在本文的研究中, 也发现Baricitinib对新冠病毒感染引起的Ⅰ 型干扰素、ISGs具有更加显著的抑制效应。已知, 干扰素在病毒感染早期发挥重要的抗病毒作用, 过量的干扰素表达也会诱导病毒识别受体分子表达和细胞凋亡, 有助于病毒在体内的复制和传播[18, 19, 20, 21], 因此, 使用该药物治疗COVID-19患者要非常慎重[9, 19, 20]。
目前临床试验也是将该药物联合抗病毒药物瑞德西韦治疗重症COVID-19患者, 可大大缩短疾病的转归期[9, 22]。2021年2月发表在Cell期刊的一篇基础性研究表明使用该药物治疗感染 SARS-CoV-2 的恒河猴时, 降低了气道巨噬细胞的炎症反应, 减少了组织损伤, 但并不抑制组织和器官中的病毒载量[23]。另外也有研究表明该药物可通过阻止病毒进入受体细胞而发挥抑制病毒复制的作用[14, 24, 25], 本文的研究尚未发现该现象。
据统计, 大约 80% 的 COVID-19 患者无需额外治疗即可清除病毒并完全康复[9]。20% 的患者会发展为中重度肺炎需住院治疗。这些中重症患者体内会出现过激的炎症反应, 也称细胞因子风暴综合征, 并通过 JAK-STAT 通路使 Ⅱ 型 (γ ) 和 IL-6 水平升高[26]。因此, 巴瑞替尼的使用具有选择性, 适应于中重度COVID-19患者。此外, 考虑到巴瑞替尼的安全性问题, 迫切需要开发一种有效的诊断方法对 COVID-19 患者的整体免疫状态进行评估, 以帮助指导正确合理使用该药物。
利益冲突声明 所有作者声明不存在利益冲突
编辑:黄艳
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|