作者简介:肖朗(1985—),女,硕士,主治医师,研究方向:结核病的诊治。
目的 探究活动性肺结核(active pulmonary tuberculosis, APTB)患者外周血单个核细胞中沉默信息调节因子1(silent information regulator 1, SIRT1)、叉头框蛋白O3(forkhead box protein O3, FOXO3)水平与巨噬细胞相关细胞因子诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、精氨酸酶-1(arginase-1, Arg-1)的相关性。方法 选取2020年1月—2021年12月期间于重庆医科大学附属第一医院渝北医院接受治疗的64例APTB患者为APTB组,选取59例潜伏结核感染(LTBI)者为LTBI组,同期选取62例健康体检人群作为对照组。实时荧光定量PCR(qPCR)法进行外周血单个核细胞中SIRT1 mRNA、FOXO3 mRNA水平检测,ELISA法进行血清iNOS、Arg-1水平检测;采用ROC曲线分析SIRT1 mRNA、FOXO3 mRNA水平对LTBI、APTB的鉴别诊断价值;采用Pearson相关分析APTB患者外周血单个核细胞SIRT1 mRNA、FOXO3 mRNA与血清iNOS、Arg-1水平相关性。结果 对照组、LTBI组、APTB组外周血单个核细胞SIRT1 mRNA、FOXO3 mRNA及血清iNOS水平依次降低,血清Arg-1水平依次升高( P<0.05)。SIRT1 mRNA、FOXO3 mRNA水平鉴别诊断LTBI、APTB的AUC分别为0.876、0.887,灵敏度分别为71.2%、76.3%,特异度分别为96.9%、90.6%。APTB患者外周血单个核细胞SIRT1 mRNA与FOXO3 mRNA水平呈正相关( r=0.500, P<0.05),且二者与血清iNOS呈正相关,与血清Arg-1呈负相关( P<0.05)。APTB患者治疗6个月后外周血单个核细胞SIRT1 mRNA、FOXO3 mRNA及血清iNOS高于治疗前,血清Arg-1低于治疗前( P<0.05)。结论 APTB患者外周血单个核细胞中SIRT1 mRNA、FOXO3 mRNA水平较低,且二者与巨噬细胞相关细胞因子iNOS呈正相关,与Arg-1呈负相关。
Objective To explore the correlation between the levels of silent information regulator 1 (SIRT1) and forkhead box protein O3 (FOXO3) in peripheral blood mononuclear cells of patients with active pulmonary tuberculosis (APTB) and macrophage-related cytokines-inducible nitric oxide synthase (iNOS) and arginase-1 (Arg-1).Methods A total of 64 APTB patients who were treated in Yubei Hospital, the First Affiliated Hospital of Chongqing Medical University from January 2020 to December 2021 were gathered as the APTB group, 59 people with latent tuberculosis infection (LTBI) were gathered as the LTBI group, and 62 healthy people were gathered as the control group. Quantitative real-time PCR (qPCR) method was performed to measure the levels of SIRT1 mRNA and FOXO3 mRNA in peripheral blood mononuclear cells. The enzyme-linked immunosorbent assay (ELISA) was performed to measure serum iNOS and Arg-1 levels; ROC curve was used to analyze the value of SIRT1 mRNA and FOXO3 mRNA levels in the differential diagnosis of LTBI and APTB; Pearson correlation was performed to analyze the correlation of SIRT1 mRNA and FOXO3 mRNA in peripheral blood mononuclear cells of APTB patients with serum iNOS and Arg-1 levels.Results The levels of SIRT1 mRNA, FOXO3 mRNA and serum iNOS in peripheral blood mononuclear cells decreased in control group, LTBI group and APTB group, and the level of serum Arg-1 increased in turn ( P<0.05). The AUCs of SIRT1 mRNA and FOXO3 mRNA in differential diagnosis of LTBI and APTB were 0.876 and 0.887, respectively, the sensitivity was 71.2% and 76.3%, and the specificity was 96.9% and 90.6% respectively. The levels of SIRT1 mRNA and FOXO3 mRNA in peripheral blood mononuclear cells of APTB patients were positively correlated ( r=0.500, P<0.05), and they were positively correlated with serum iNOS and negatively correlated with serum Arg-1 ( P<0.05). The SIRT1 mRNA, FOXO3 mRNA and serum iNOS in peripheral blood mononuclear cells of APTB patients after 6 months of treatment were higher than those before treatment, and serum Arg-1 was lower than before treatment ( P<0.05).Conclusions The levels of SIRT1 mRNA and FOXO3 mRNA in peripheral blood mononuclear cells of APTB patients are low, and they are positively correlated with macrophage-related cytokine iNOS and negatively correlated with Arg-1.
结核病是由结核分枝杆菌感染而引起的一种慢性传染病, 环境污染及艾滋病的流行可使其发病率增加, 疾病进入活动期后威胁人类健康[1, 2]。活动期肺结核(active pulmonary tuberculosis, APTB)患者体内免疫功能低下, 此时巨噬细胞可发挥重要作用[3]。潜伏结核感染(latent tuberculosis infection, LTBI)是指结核菌通过人体呼吸道后, 一部分被杀灭, 大部分潜伏在人体中与人体处于共存状态, 但无发病[4]。诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)、精氨酸酶-1(arginase-1, Arg-1)作为两种巨噬细胞特征性标志物, 可表征其免疫功能变化[3]。沉默信息调节因子1(silent information regulator 1, SIRT1)可通过转移组蛋白赖氨酸残基乙酰胺基组分中的乙酰基进行去乙酰化, 进而参与机体内细胞增殖、凋亡、炎症反应等众多过程[5, 6]。叉头框蛋白O3(forkhead box protein O3, FOXO3)被称为肿瘤抑制器, 在人类多种恶性肿瘤中表达异常[7, 8]。SIRT1、FOXO3与APTB的相关性目前尚未明确, 因此本研究旨在初步分析APTB患者中SIRT1、FOXO3与巨噬细胞相关细胞因子的相关性及鉴别诊断LTBI、APTB的价值, 为进一步探究SIRT1、FOXO3在APTB中的具体作用机制提供参考。
选取2020年1月— 2021年12月期间于重庆医科大学附属第一医院渝北医院接受治疗的64例APTB患者为APTB组, 男38例, 女26例, 平均年龄(38.94± 8.71)岁; 选取59例LTBI者为LTBI组, 男35例, 女24例, 平均年龄(39.01± 9.12)岁; 同期选取62例健康体检人群作为对照组, 男37例, 女25例, 平均年龄(37.94± 9.28)岁。
纳入标准:(1)APTB患者符合诊断标准[9], LTBI者诊断依照WHO推荐的结核分枝杆菌感染诊断参考技术T-SPOT.TB为依据筛查, 具体标准为:T-SPOT.TB有反应性; 无结核病史、肺部疾病史及结核临床表现, 胸片正常; 既往存在肺结核接触史; (2)APTB入组前均未进行过抗结核治疗。(3)研究对象临床资料完整, 可配合治疗, 依从性较好; (4)健康体检人群体格检查无异常, 既往无结核相关临床症状及病史, 胸部放射检查正常, T-SPOT.TB无反应性、临床表现及相关辅助检查无异常; (5)试验经医院临床伦理委员会审批通过, 所有研究对象自愿参加研究, 并签署同意书。排除标准:(1)合并人类免疫缺陷病毒阳性及自身免疫性疾病者; (2)近3个月有免疫抑制或增强药物服用史者; (3)合并脏器严重疾病或肿瘤者; (4)肺部真菌感染者。
1.2.1 治疗方法 APTB患者顿服异烟肼0.3 g/次, 1次/d; 空腹顿服利福平0.45 g/次, 1次/d; 顿服乙胺丁醇0.75 g/次, 1次/d; 顿服吡嗪酰胺1.5 g/次, 1次/d, 连续治疗6个月。
1.2.2 样品收集、处理及保存 采集APTB患者(治疗前、治疗6个月后)及LTBI者空腹外周静脉血样, (1)血清:部分血样静置60 min后, 3 000 r/min(离心半径 10 cm)离心15 min后收集血清, 保存于-80 ℃冰箱, 用于iNOS、Arg-1水平检测; (2)外周血单个核细胞:部分血样加同等体积生理盐水混匀, 加入到含有人外周血淋巴细胞分离液(上海吉至生化科技有限公司)的离心管中, 2 000 r/min (离心半径10 cm)离心30 min后收集中间层细胞即为外周血单个核细胞, 采用PBS缓冲液洗涤后用于SIRT1 mRNA、FOXO3 mRNA水平检测。
1.2.3 T-SPOT.TB检测 采集各研究对象外周静脉血, 置于CPT真空管中, 按操作说明书(试剂盒购自英国Oxford Immunotec公司)采用ELISPOT法进行检测, 测定T-SPOT.TB结果。
1.2.4 外周血单个核细胞SIRT1 mRNA、FOXO3 mRNA水平检测 RNA提取试剂盒(北京凯诗源生物科技有限公司)提取总RNA后反转录试剂盒(日本TAKARA公司)反转录得cDNA, 实时荧光定量PCR(quantitative real-time PCR, qPCR)法进行外周血单个核细胞中SIRT1 mRNA、FOXO3 mRNA水平检测。qPCR扩增程序:95 ℃预变性5 min; 95 ℃变性30 s, 63 ℃退火30 s, 40个循环。选取人甘油醛-3-磷酸脱氢酶(GAPDH)为内参, 各引物序列见表1。利用2-∆ ∆ CT法计算外周血单个核细胞SIRT1 mRNA、FOXO3 mRNA的相对含量。应用ROC曲线分析SIRT1 mRNA、FOXO3 mRNA水平鉴别诊断LTBI、APTB的效能。
| 表1 qPCR引物序列 Table 1 qPCR primer sequences |
1.2.5 血清iNOS、Arg-1水平检测 采用ELISA法检测研究对象iNOS(上海优利科生命科学有限公司)、Arg-1(武汉菲恩生物科技有限公司)水平, 其操作步骤按照试剂盒说明书进行。
采用SPSS 25.0软件包对数据进行分析, 正态分布或接近正态分布的计量资料均采用(x± s)描述, 采用独立样本或配对样本t检验比较两组间计量资料差异, 采用单因素方差分析比较三组间计量资料差异, 进一步组间两两差异比较采用SNK-q检验; 采用ROC曲线分析SIRT1 mRNA、FOXO3 mRNA水平对LTBI、APTB的鉴别诊断价值; 采用Pearson相关分析APTB患者外周血单个核细胞SIRT1 mRNA、FOXO3 mRNA与血清iNOS、Arg-1水平相关性。P< 0.05为差异有统计学意义。
APTB组外周血单个核细胞SIRT1 mRNA、FOXO3 mRNA水平低于LTBI组和对照组(P< 0.05)。LTBI组外周血单个核细胞SIRT1 mRNA、FOXO3 mRNA水平低于对照组(P< 0.05)。见表2。
| 表2 3组外周血单个核细胞中SIRT1 mRNA、FOXO3 mRNA水平比较 Table 2 Comparison of SIRT1 mRNA and FOXO3 mRNA levels in peripheral blood mononuclear cells of three groups |
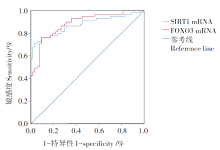
SIRT1 mRNA和FOXO3 mRNA诊断AUC分别为0.876(95%CI: 0.811~0.942)、0.887(95%CI: 0.828~0.945), 灵敏度分别为71.2%、76.3%, 特异度分别为96.9%、90.6%, 临界值分别为0.50、0.59。见图1。
APTB组血清Arg-1水平高于LTBI组和对照组, iNOS水平低于LTBI组和对照组(P< 0.05)。LTBI组血清Arg-1水平高于对照组, iNOS水平低于对照组(P< 0.05)。见表3。
| 表3 3组血清iNOS、Arg-1水平比较 Table 3 Comparison of serum iNOS and Arg-1 levels in three groups |
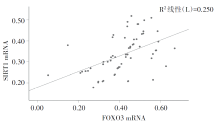
Pearson相关分析结果显示, APTB患者外周血单个核细胞SIRT1 mRNA与FOXO3 mRNA水平呈正相关(r=0.500, P< 0.05), 且SIRT1 mRNA、FOXO3 mRNA与血清iNOS呈正相关(r=0.495, 0.502, P< 0.01), 与血清Arg-1呈负相关(r=-0.489, -0.492, P< 0.01)。见图2。
APTB患者治疗6个月后外周血单个核细胞SIRT1 mRNA、FOXO3 mRNA及血清iNOS高于治疗前, 血清Arg-1低于治疗前(P< 0.05)。见表4。
| 表4 APTB患者治疗前后外周血单个核细胞SIRT1 mRNA、FOXO3 mRNA及血清iNOS、Arg-1水平比较 Table 5 Comparison of SIRT1 mRNA, FOXO3 mRNA and serum iNOS and Arg-1 levels in peripheral blood mononuclear cells of APTB patients before and after treatment |
LTBI多数情况下无症状且无传染性, 结核分枝杆菌以休眠非复制的状态存在于受感染宿主器官肉芽肿巨噬细胞中, 此时机体内结核分枝杆菌与免疫反应处于动态平衡, 若此动态平衡被打破可导致结核分枝杆菌复制和再活化, 即发生APTB[10, 11, 12]。APTB具有较高的传染性及公共危害性[13]。因此, 早期快速诊断APTB是预防其传播的有效手段。
APTB致病过程中最关键的环节是巨噬细胞与结核分枝杆菌间相互作用, 巨噬细胞可通过一系列机制抑制或杀灭结核分枝杆菌, 进而参与机体抗结核免疫保护作用[14]。因此探究巨噬细胞相关细胞因子水平在APTB中的变化情况, 对进一步探讨APTB致病机制有重要意义。研究表明, 巨噬细胞被不同病原微生物刺激后可极化为M1、M2两种亚型, 两种亚型分泌的细胞因子具有相反的生物学效应[15]。M1型巨噬细胞可分泌iNOS等促炎细胞因子促进细胞免疫, 而M2型巨噬细胞可分泌Arg-1等抗炎细胞因子[3]。PARK等[16]研究表明, 结核性胸腔积液患者中M2型巨噬细胞及其相关细胞因子表达升高。本研究同样发现, APTB患者中M1型巨噬细胞相关细胞因子iNOS表达下调, M2型巨噬细胞相关细胞因子Arg-1表达上调。提示APTB患者中可能有M1、M2型巨噬细胞极化的现象, 此时巨噬细胞免疫系统功能不足, 此结果与HUANG等[17]及代娇等[3]的研究结论相似。
SIRT1是一种去乙酰化酶, 与抗氧化应激、细胞衰老、炎症反应等多种活动有关, 且参与与多种促炎因子和抗炎因子的表达, 是炎症反应中重要的调控因子[18]。叶新春等[19]研究显示, 结核分枝杆菌感染后SIRT1表达水平下调, 抗结核治疗后SIRT1水平显著上升。FOXO3是FOXO家族中的一员, 且是SIRT1下游调节的靶基因之一, SIRT1可通过去乙酰化作用调控FOXO3转录活性, 进而在疾病进展中发挥重要作用[20]。本研究结果显示, APTB患者外周血单个核细胞中SIRT1 mRNA、FOXO3 mRNA水平均明显低于LTBI者和健康人群, 且二者表达水平与血清iNOS、Arg-1均呈明显的相关性。提示SIRT1 mRNA、FOXO3 mRNA可能参与了APTB的病因学过程, 基于本研究相关性结果及既往文献中APTB的病因学研究推测病原微生物刺激机体后, SIRT1 mRNA、FOXO3 mRNA表达失调, 进而影响M1、M2巨噬细胞极化, 调控其相关细胞因子iNOS、Arg-1的表达, 造成部分感染患者巨噬细胞免疫系统功能不足, 导致APTB发生发展, 但其作用机制仍不十分明确, 有待今后通过APTB小鼠模型进一步阐明SIRT1 mRNA、FOXO3 mRNA在APTB巨噬细胞极化中的调控机制。
绘制ROC曲线结果显示SIRT1 mRNA、FOXO3 mRNA水平鉴别诊断LTBI、APTB的效能较高, 特异度可达96.9%、90.6%。提示临床医师在通过临床症状及其他表现鉴别诊断LTBI、APTB的同时, 也可辅助监测生化指标SIRT1 mRNA、FOXO3 mRNA的变化, 增加鉴别诊断的准确性。此外, 本研究结果显示, APTB患者治疗6个月后SIRT1 mRNA、FOXO3 mRNA、iNOS水平升高, Arg-1水平降低。提示SIRT1 mRNA、FOXO3 mRNA可同样作为监测APTB患者治疗疗效的良好指标, 临床中可通过监测二者水平变化及时调整治疗方案。
综上, APTB患者外周血单个核细胞中SIRT1 mRNA、FOXO3 mRNA异常低表达, 且二者与M1、M2型巨噬细胞相关细胞因子iNOS、Arg-1呈明显相关性, 可能参与APTB疾病的发生发展。且治疗后SIRT1 mRNA、FOXO3 mRNA水平逐渐升高, 二者可能成为APTB患者治疗疗效及预后的评估指标。然而本研究中未能对SIRT1 mRNA、FOXO3 mRNA与APTB间的因果关系进行深入探讨, 有待今后基础研究验证。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|