刚地弓形虫是一种世界范围内广泛分布的机会性致病原虫,能引起人兽共患的弓形虫病,严重威胁着人类的健康。近年来,刚地弓形虫感染与精神疾病的关系越来越受到重视。弓形虫感染对神经系统的影响与多种神经精神疾病的发病有关,如精神分裂症、抑郁症,阿尔兹海默症等。本文综述弓形虫感染与神经精神疾病之间的关系及可能存在的致病机制,通过相关致病机制的研究,期望能为临床治疗弓形虫感染导致的神经精神疾病提出新的治疗方向和可行方案。
Toxoplasma gondii, an opportunistic pathogenic protozoan, is widely distributed worldwide and can cause zoonoses, which is a serious threat to human health. Nowadays, the relationship between T. gondii infection and neuropsychiatric diseases has attracted researchers' attention increasingly. T. gondii infection is related to the pathogenesis of many neuropsychiatric diseases by affecting the nervous system, such as schizophrenia, depression, Alzheimer's disease, and so on. This review will focus on the relationship between T. gondii infection and neuropsychiatric diseases and summarizes the possible mechanisms of disorders resulting from T. gondii infection. It is expected that the study on the related pathogenic mechanism of T. gondii will lead to new therapeutic directions and feasible solution for the clinical treatment of neuropsychiatric diseases caused by T. gondii infection.
刚地弓形虫(Toxoplasma gondii)是一种可专性寄生在人与绝大部分温血动物体内的机会性致病原虫。该虫在世界范围内分布广泛, 可寄生动物宿主的种类也十分广泛, 是引起人兽共患寄生虫病的重要病原体之一, 严重威胁着人类的健康。据统计, 全球约三分之一人口弓形虫血清抗体呈阳性, 但该虫感染率有明显的地域差异[1]。有资料表明, 弓形虫具有嗜神经性, 神经系统疾病与弓形虫感染关系密切, 其感染会造成神经系统的功能异常, 导致精神疾病, 比如与精神分裂症、抑郁症、孤独症等多种疾病的发病有关[2]。
精神分裂症是一种具有感知、思维、情感和意志行为等多个方面的异常, 以精神活动和环境不协调为特征, 慢性长期的功能逐渐丧失的精神障碍类疾病[3]。目前大多数研究都以血清中 IgG水平为弓形虫感染指标提示精神分裂症与弓形虫的相关性, 研究发现精神分裂症患者血清中弓形虫IgG抗体阳性率明显高于正常对照组[4, 5]。此外, KEZAI等[6]研究提示弓形虫感染可促进精神分裂症的发生。MORTENSEN等[7]在丹麦展开关于新生儿与弓形虫的研究也支持此观点, 他们检测了1981年及以后出生的新生儿弓形虫体内的抗体, 并进行长期随访, 观察这部分新生儿在后期是否发展为精神分裂症, 结果表明, 后期发展为精神分裂症的新生儿血清中弓形虫IgG抗体阳性率显著高于未发病的新生儿。弓形虫感染不仅促进精神分裂症的发生, 在一定程度上还加重精神分裂症患者的病情和加重临床症状及认知功能障碍。申连城等[8]研究通过选取首发精神分裂症患者, 根据血清弓形虫IgG抗体水平, 采用简明精神病量表、阳性症状量表、阴性症状量表, 以及蒙特利尔认知评估量表对弓形虫感染的首发精神分裂症患者的精神症状及认知障碍状况进行调查, 并与未被弓形虫感染的首发精神分裂症患者相应状况进行比较从而证实了这一点。还有研究发现抗精神分裂的药物可抑制弓形虫的活性, 2014年FOND等[9]研究发现第一代治疗精神分裂的药物氯哌噻吨有较高的抗弓形虫活性。同样, 2021年ENSHAEIEH 等[10]发现另一种抗精神分裂的药物丙戊酸也可抑制小鼠慢性弓形虫感染。弓形虫导致精神分裂症的机制还尚未明确, 以下为近年的研究结果。
阿尔兹海默症是老年人中常见的一种中枢神经系统退行性病变, 主要表现为在日常生活中记忆及认知功能的进行性减退, 并伴有各种精神症状及行为障碍[17]。NAYERI等[17]进行系统的Meta分析, 结果表明弓形虫是阿尔兹海默症发展和症状恶化的危险因素之一[OR=1.53, 95%CI(1.07~2.18)]。此外, 动物模型证明弓形虫感染可能诱发阿尔兹海默症的组织病理学特征[18]。阿尔兹海默症的发病机制十分复杂, 弓形虫感染与阿尔兹海默症的机制关系的研究成果如下(图1)。
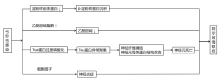 | 图1 弓形虫感染与阿尔兹海默症机制关系Fig.1 The relationship between Toxoplasma gondii infection and the mechanism of Alzheimer's disease |
β -淀粉样蛋白(Aβ )大量沉积于阿尔兹海默症患者的脑部, 形成淀粉样蛋白斑, 这是引发阿尔兹海默症的重要因素[19]。弓形虫感染患者后, 患者淀粉样蛋白通路的失调, 淀粉样前体蛋白(APP)水平下降, 可能由于APP的异常裂解, 致使Aβ 在脑组织中大量沉积, 引发阿尔兹海默症[20, 21]。
阿尔兹海默症主要影响的神经递质是乙酰胆碱(Ach), 随着乙酰胆碱酯酶(AChE)的活性改变, 这个过程会导致学习、记忆、认知方面的多种障碍[21]。感染弓形虫后, 会影响AChE高释放而降低Ach的水平, 进而影响受感染的宿主的学习记忆活动, 造成学习记忆障碍[17]。
抑郁症以显著且持久的心境低落、思维迟缓、认知功能损害、意志活动减退为主要特征的一类心理障碍疾病, 并且它会对人的消化、免疫及神经系统等产生影响甚至造成损伤[26]。 抑郁与自杀倾向密切相关, 自杀行为是抑郁症的最常见并发症。在自杀死亡的病例中高达50%的人患有抑郁症[27]。有报道表明, 弓形虫感染与抑郁症和自杀倾向的发生有联系[28, 29]。大部分报道是通过血清学方法对照研究探讨了它们之间可能存在的关系。ARLING等[28]在一项218名参与者的研究中首次报道弓形虫感染与自杀行为之间的关系。他们发现有自杀企图史的抑郁症患者比无自杀企图患者的弓形虫IgG水平更高。相关药物性研究则显示, 抑郁症患者对抗抑郁药反应不佳, 对此进行了调查, 并在弓形虫血清学检测中发现阳性。在对弓形虫进行适当的治疗后, 抗抑郁治疗的效果才有所改善[29]。弓形虫引起抑郁症与自杀倾向的病理生理机制至今仍不清楚, 主要研究成果认为弓形虫感染患者后, 能够激发宿主的免疫反应, 引起宿主脑内免疫细胞和分子分布的改变, 机体释放炎性细胞因子进而引起神经内分泌以及免疫系统功能的紊乱, 引起抑郁症的发生。许多研究报告抑郁症患者的炎症细胞因子水平升高。细胞因子包括白细胞介素、肿瘤坏死因子-α 和干扰素-γ 等, 可能间接改变脑神经递质水平[30]。激活神经递质的免疫途径又分为两种(图2)。
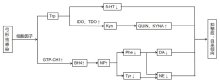 | 图2 弓形虫感染与抑郁症、自杀倾向机制关系Fig.2 The relationship between Toxoplasma gondii infection and depression and suicidal tendency |
细胞因子通过诱导吲哚胺- 2, 3 -双加氧酶(IDO)与色氨酸2, 3-双加氧酶(TDO)的激活与Trp的消耗。Trp代谢途径分为两种, 一种是通过色氨酸5-羟化酶脱羧形成血清素(5-HT)。另一种途径是通过TDO和IDO进行的KP。炎症细胞因子激活代谢酶IDO, IDO过度激活导致Trp消耗, 伴有5-HT合成明显下降。其次, IDO活性的升高可以加速Trp循KP分解进而降低其向血清素途径代谢, 进一步降低突触间5-HT的水平。由于5-HT水平的降低, 抑郁和自杀行为可能会发生。另一种解释是, IDO介导的犬尿氨酸通路的代谢物Kyn产生增加, Kyn产生可能诱发抑郁症本身的核心症状, 或随后产生进一步的下游神经反应性代谢物, 如KYNA和QUIN, 这些物质的增加可在抑郁症患者的血清中观察到[26, 30, 31, 32, 33]。
干扰素-γ 和其他促炎细胞因子诱导鸟苷-三磷酸-环水解酶-1(GTP-CH1)激活, 通过四氢生物蝶呤(BH4)的产生促进新喋呤(NP)的产生, 降低苯丙氨酸(Phe)和酪氨酸(Tyr)水平。Phe是去甲肾上腺素(NE)和DA合成的前体物质, Tyr是NE合成的前体物质, 这可降低中枢神经突触间隙NE与DA的水平, 进而可能导致抑郁症的发生[30, 31, 33]。此外, 在神经系统上, 弓形虫对杏仁核有特殊的亲和力, 杏仁核参与恐惧和焦虑的神经回路, 2014年的一项研究中检测了雄性小鼠脑组织内侧杏仁核精氨酸加压素基因(AVP)甲基化水平, 发现感染后宿主AVP启动子低甲基化, 基因表达增加, 导致睾酮分泌增加并最终导致受感染小鼠对猫尿味的恐惧减少, 从而诱导自杀行为[34]。
孤独症是一种以社会交往障碍、言语和非言语交流缺陷、兴趣狭窄和行为刻板等为主要临床特征的广泛发展障碍的疾病。近年有报道, 弓形虫感染与孤独症有关。近期的一项Mate分析结果表明弓形虫感染是孤独症的危险因素之一, 潜伏弓形虫感染患者是健康对照组的1.93(95%CI:l1.01~3.66)倍[35]。SPANN等[36]研究结果表明, 母亲弓形虫抗体与儿童孤独症的几率之间的关系可能与对这种病原体的免疫反应或免疫系统的整体激活有关。同时, XU等[37]进一步研究发现通过建立了母体免疫激活(MIA)的新型疾病动物模型— 即用弓形虫的STAg抗原孕期造模, 揭示了MIA影响子代免疫系统并造成孤独症相关表型(社交障碍、重复刻板行为等)的机制, 并发现可以通过调节成年期子代小鼠的免疫系统改善其孤独症表型。ABDOLI等[38]发现弓形虫感染能够通过母婴传播并且能导致男性睾酮分泌异常增高, 从而提高了孤独症的患病率。
现如今, 人们已经了解刚地弓形虫的形态结构、生活史、流行病学以及感染后的主要临床症状等。弓形虫感染与神经系统疾病之间存在相关性, 在先天性感染或免疫受损的宿主中, 弓形虫可造成严重的神经系统疾病, 至今通过各种研究已经明确证明了这一结论, 包括感染后精神疾病发生的临床阶段、感染的动物模型建立以及相关抗体的血清学检测实验等。但是, 弓形虫生物学特征的多样性与神经系统结构和功能的复杂性, 决定了研究弓形虫感染与神经系统疾病的直接关系和作用机制非常困难, 其机制还尚不明确。未来的研究应该着眼于动物模型的分子病理学研究以及临床试验大量标本数据的采集分析, 以期待寻找到更加清晰确定的致病分子机制。通过相关致病机制的研究, 能为临床治疗刚地弓形虫感染导致的精神疾病提出新的治疗方向和可行方案。同时可以加深我们关于相关病原生物学感染对精神疾病影响的认识, 对于非刚地弓形虫感染所致精神疾病的可能发病机制的研究, 则具有借鉴和类比意义。
利益冲突声明 所有作者声明不存在利益冲突
编辑:符式刚
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|


