作者简介:谢兴凤(1988—),女,硕士,主管检验师,研究方向:临床微生物诊断。
Objective To detect in vitro antibacterial activities of new short fragment protein LytA′ from Streptococcus pneumoniae ATCC49619 obtained by prokaryotic expression system, and compare with penicillin G at the same time.Methods Specific primers were designed in accordance with the lytA gene sequence, and the lytA gene from Streptococcus pneumoniae (ATCC49619) was amplified using PCR. The lytA gene was inserted into prokaryotic expression vector PGM-T to construct PGM-T/lytA recombinant plasmid. The new short fragment lytA′ gene was obtained through digesting PGM-T/lytA with BamHⅠ and HindⅢ. Then expressing plasmid pET-32a(+)/ytA′ which had been well constructed and sequentially confirmed respectively were transformed into E.coliBL21 and induced by IPTG to express the target protein LytA′. The target proteins LytA′ were purified by dialysis bag isoelectric point elution technology, detected by SDS-PAGE. The minimum inhibitory concentrations (MIC) of LytA’ and penicillin G against Streptococcus pneumoniae(ATCC49619) were determined by broth dilution method, and the antimicrobial activity of LytA’ was preliminarily studied by using LytA’ and penicillin G to penicillin G-sensitive Streptococcus pneumoniae.Results The recombinant plasmids PGM-T/lytA and pET-32a (+)/lytA′ were successfully constructed. The recombinant autolysin protein expressed well and showed expected antimicrobial activity. Compared with growth control group, LytA’ and penicillin G showed obvious antibacterial activity at 3 h ( t=14.243 0, P<0.011 0; t=7.400 0, P<0.022 0), and the antibacterial effect lasted until 7 h ( t=20.838 0, P<0.008 0; t=17.889 0, P<0.017 0). The antibacterial effect was gradually enhanced. In addition, the antibacterial activity of LytA’ at 7 h was significantly stronger than that of penicillin G ( t=6.764 0, P<0.027 0).Conclusions The short fragment autolysin recombinant protein LytA’ shows certain antibacterial activity against penicillin G-sensitive Streptococcus pneumoniaein vitro, and the duration is long. It has the possibility of becoming an anti- Streptococcus pneumoniaetherapeutic agent.
肺炎链球菌为鼻咽部的正常定植菌, 主要引起各种感染性疾病, 近年来, 除在呼吸道感染和脑膜炎、脓毒血症等侵袭性感染中经常分离出外, 在儿童骨关节及软组织感染中亦可被分离出[1]。在我国, 肺炎链球菌感染引起的疾病是严重的公共卫生问题之一, 因在儿童及中老年人群中具有高发病率, 一直备受关注[2]。肺炎链球菌感染引起的疾病以抗生素治疗为主, 由于抗生素的广泛使用, 已导致该菌对大环内酯内抗生素高耐药[3], 下呼吸道肺炎链球菌感染中头孢呋辛的耐药率已有逐渐增加的趋势[4], 临床经验用药依然以青霉素为主。但有研究表明, 在儿童侵袭性肺炎链球菌感染疾病中, 脑膜炎分离的肺炎链球菌对青霉素、头孢噻肟和头孢吡肟的耐药率明显高于血流感染[5]。肺炎链球菌耐药情况不容乐观, 但病原学检测仍然存在诸多缺陷, 如传统培养法灵敏度低, 无法区分定植和感染; 分子生物学方法灵敏度高, 但推广率低。随着13价肺炎链球菌结合疫苗(PCV13)和23价荚膜多糖疫苗(PPV23)的普及, 疫苗覆盖血清型所致感染有所降低, 但多个文献结果表明, 两种疫苗的覆盖率不到70%, 多以婴幼儿为主, 中老年人覆盖率较低, 可能成为非疫苗覆盖血清型肺炎链球菌的储存库, 并且发现青霉素不敏感菌株大多为PCV13疫苗血清型[6, 7]。有研究提示, 低浓度的青霉素G和头孢噻肟可诱导大多数肺炎链球菌临床菌株pbps-mRNAs水平下调, 从而提高该菌对抗生素的耐药性[8]。因此, 肺炎链球菌感染的防治仍然要以快速精准检测、保护性疫苗研制和新药研发为主。新型抗生素的研发也一直是治疗肺炎链球菌感染的热点[9, 10], 本文从治疗的角度, 通过原核表达技术表达纯化肺炎链球菌小片段自溶素重组蛋白LytA′ , 并初步探讨其体外抗菌活性, 以期为LytA′ 是否具有新药研发价值提供一定依据。
肺炎链球菌标准菌株(ATCC49619)由卫生部临床检验中心提供; 细菌基因组DNA提取试剂盒购于北京庄盟生物公司; 限制性核酸内切酶BamHⅠ 和HindⅢ 、T4 DNA连接酶、DNA Marker、蛋白质Marker、DNA凝胶回收试剂盒等均购于大连Takara公司; 克隆载体PGM-T、2× Taqplus PCR MasterMix和质粒提取纯化试剂盒购于天根生化科技有限公司; 表达载体为本实验室保存; 感受态细胞大肠埃希菌DH5α 和BL21(DE3)购于美国Novagen公司。
PX2型PCR仪(Thermo公司); 核酸电泳仪和蛋白质电泳仪(大连竞迈公司); 超声粉碎仪(宁波海曙科超声设备公司); 凝胶成像分析仪(UVPONC公司)。
1.3.1 特异性引物设计 搜索GenBank中肺炎链球菌M66菌株的自溶素基因lytA设计引物, 并在引物中插入核酸限制性内切酶BamHⅠ 和HindⅢ 的位点。引物为:上游:5’ -GGGGGATCCATGGAAATTAATGTGAGT-3’ ; 下游:5’ -GGGAAGCTTTTTTACTGTAATCAAGCCATC-3’ (序列中粗体部分为限制性核酸内切酶位点)。特异性引物由大连宝生物公司设计并合成。
1.3.2 扩增目的基因并构建克隆质粒 提取肺炎链球菌(ATCC49619)基因组DNA, PCR扩增lytA基因。程序为预变性95 ℃ 4 min; 变性95 ℃ 30 s, 退火56 ℃ 30 s, 延伸72 ℃ 1 min, 执行30个循环; 最后保温72 ℃ 5 min。采用1%的琼脂糖凝胶电泳分析扩增产物, 并在紫外灯下进行目的片段lytA的凝胶回收。将克隆质粒PGM-T/lytA转化至DH5α 感受态细胞中, 再将转化菌液接种至LB/Amp/IPTG/X-Gal平板, 经蓝白斑筛选出目的克隆菌落, 最后将目标菌进行增菌培养, 浓缩集菌后提取克隆质粒并送至大连Takara公司进行双向测序, 测序结果与GenBank中M66菌株的自溶素基因lytA进行Blast比对, 以此确定是否正确插入目的片段。
1.3.3 构建表达质粒 构建并鉴定重组表达质粒pET-32a(+)/lytA′ , 将测序正确的克隆质粒和表达载体pET-32a(+)分别用限制性核酸内切酶BamHⅠ 和HindⅢ 进行切割, 1%凝胶电泳检测酶切结果, 用凝胶回收试剂盒分别纯化回收酶切后的目的基因片段lytA′ 和pET-32a(+), 并于16 ℃过夜连接。将连接产物转化至感受态细胞大肠埃希菌DH5α , 转化菌液经LB/Amp固体平板抗性筛选出含重组表达质粒pET-32a(+)/lytA′ 的菌株, 并经PCR鉴定确实含有重组表达质粒。选单个经过鉴定的克隆菌落进行增菌培养, 集菌后提取重组表达质粒, 双酶切鉴定并再次送至大连Takara公司进行双向测序, 测序结果与重组克隆质粒中自溶素基因lytA进行Blast比对, 以此确定插入片段为目的片段。
1.3.4 诱导表达与纯化 将上述提取的表达质粒pET-32a(+)/lytA′ 转化至感受态菌BL21(DE3)中, 接种至LB/Amp平板, 筛选出单个含表达质粒的菌落, 再转种至LB/Amp液体培养基中, 37 ℃摇菌培养至对数生长期(A600=0.6~0.8), 加入IPTG, 终浓度为1 mmol/L, 25 ℃诱导4 h, 4 000 r/min(离心半径为13.5 cm)离心 10 min, 离心后, 弃去上清, 加超声裂解液, 冰浴条件下超声裂解沉淀, 超声裂解后4 ℃离心, 将上清液和沉淀进行SDS-PAGE电泳, 经考马斯亮蓝R250染色分析确定诱导蛋白的分子量和条带位置。最后, 纯化后诱导蛋白LytA′ 用透析袋等电点洗脱法回收并定量分析。
1.3.5 最小抑菌浓度(MIC)测定及体外抑菌试验 采用微量肉汤稀释法测定MIC。将肺炎链球菌(ATCC49619)接种至血平板, 37 ℃孵育18~24 h, 用生理盐水调菌悬液至0.5麦氏浊度, 用MH肉汤(含10%胎牛血清)稀释100倍制作成待测菌液(菌液浓度为1× 106CFU/mL)。在无菌96孔板中按1∶ 1体积加入药物和待测菌液, 药物终浓度为3倍该药物的MIC, 生长对照孔同时也按1∶ 1体积加入待测菌液和无菌PBS, 对照孔菌液的终浓度与药物孔相同。37 ℃恒温培养, 分别于1、3、5、7 h时, 取少量菌液, 用稀释涂布平板法进行菌落计数。
菌落计数结果以x± s表示, 采用SPSS 25.0进行数据分析, 正态分布时抑菌数的比较选用t检验和方差分析(非正态分布时选用秩和检验), P< 0.05为差异有统计学意义。
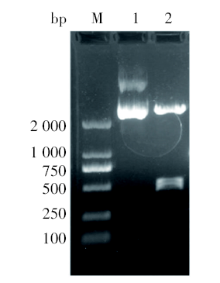
采用特异性引物从肺炎链球菌标准菌株基因组DNA中扩增出lytA基因序列片段, 经1%琼脂糖凝胶电泳鉴定, 约1 000 bp, 符合预期条带位置(956 bp)(图1)。重组克隆质粒PGM-T/ lytA插入片段与M66肺炎链球菌菌株的自溶素基因lytA序列比对, 结果符合率是98.0%。用限制性核酸内切酶BamHⅠ 和HindⅢ 双酶切重组克隆质粒, 约在500 bp处出现2条小片段, 纯化回收较大片段lytA′ 构建表达质粒。
用限制性核酸内切酶BamHⅠ 和HindⅢ 双酶切重组表达质粒pET-32a(+)/lytA′ 后, 获得一个500 bp左右的片段, 符合预期值(图2)。再次测序后证实, 重组表达质粒pET-32a(+)/lytA′ 与重组克隆质粒PGM-T/ lytA序列中相应部分符合率为100%, 没有发生变异。
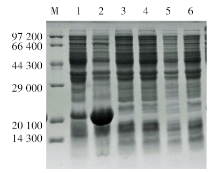
含重组表达质粒pET-32a(+)/lytA′ 的转化菌BL21(DE3)经IPTG诱导后, 在20 000处出现1 条明显加粗的蛋白条带, 为目的蛋白LytA′ , 与预期结果一致(图3)。
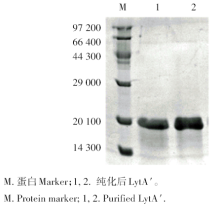
筛选出的阳性表达菌经诱导后超声裂解菌体, 用透析袋等电点洗脱法纯化回收目的蛋白, SDS-PAGE电泳显示单一蛋白条带, 分子量约20 000(图4)。LytA′ 的浓度经BCA法测定为0.81 mg/mL。
对肺炎链球菌ATCC49619, 采用微量肉汤稀释法测得LytA′ 的MIC值是64 μ g/mL, 青霉素G是0.06 μ g/mL。
与生长对照组比较, LytA′ 和青霉素G作用与肺炎链球菌ATCC49619标准菌株, 均在3 h时开始对细菌生长表现出抑菌作用, 相对于生长对照组, 菌液浓度(lg CFU/mL)显著性的降低(t=14.243 0, P< 0.011 0; t=7.400 0, P< 0.022 0), 抑菌作用持续到7 h(t=20.838 0, P< 0.008 0; t=17.889 0, P< 0.017 0), 且抑菌效果逐渐增强。LytA′ 和青霉素G比较, 仅在7 h时显示处较强的抑菌活性, 抑菌效果具有显著性差异(t=6.764 0, P< 0.027 0)。见表1。
| 表1 小片段蛋白LytA′ 和青霉素G对肺炎链球菌ATCC49619的抑菌作用 Table 1 Antibacterial effect of small fragment protein LytA′ and penicillin G on Streptococcus pneumoniae ATCC49619 |
肺炎链球菌是社区获得性肺炎的主要病原体之一, 在发达国家, 社区获得性肺炎具有较高的死亡率, 在我国的儿童及成年人中也是常见的感染性疾病之一[11], 老人感染后更有病情重、进展快、并发症多和病死率高的特点。肺炎链球菌生长约48 h时, 菌落会出现脐窝状, 而自溶素就是导致其溶解的因素之一。肺炎链球菌自溶素(pneumococcal autolysin, LytA)是细菌的主要自溶酶, 其结构和功能已基本被研究和认识[12, 13, 14]。LytA是N-乙酰胞壁酸-L-丙氨酸酰胺酶, 位于肺炎链球菌的细胞壁, 与膜磷壁酸的胆碱分子相连, 属于胆碱结合蛋白家族[15]。LytA重组蛋白可特异性作用于N-乙酰胞壁酸和肽桥之间的酰胺键, 催化肺炎链球菌多糖骨架裂解进而破坏细胞壁, 导致菌体溶解[16]。LytA可导致细胞溶解, 并在体外对肺炎链球菌具有抗菌活性早已有研究证实[17, 18]。本研究利用肺炎链球菌ATCC49619序列中444~466 bp处天然存在的BamHⅠ 酶切位点, 获得了部分基因片段lytA′ , lytA′ 基因已通过测序证实, 来源于全片段自溶素lytA基因中的一段, 在此基础上, 构建pET-32a(+)/lytA’ 质粒, 并可在原核表达系统中高效表达出约20 000且具有生物活性的小片段重组蛋白LytA′ 。
通过基因工程技术获得的小片段自溶素重组蛋白LytA′ , 由于其基因序列来源于全段自溶素基因, 我们推测该蛋白与LytA具有相同的抗菌作用, 此推测本文也已通过LytA′ 体外抑菌试验证实。在LytA′ 体外抑菌试验中, 青霉素G和LytA′ 在3倍MIC终浓度下, 均在3 h时对肺炎链球菌生长开始出现抑菌效果, 并持续至观察点7 h, 二者在7 h时抑菌效果出现明显差异。这一研究结果表明, LytA’ 具有一定的抑菌活性, 与青霉素G的抑菌效果相当。由于青霉素结合蛋白的结构改变, 出现青霉素耐药菌株, 并且对青霉素耐药的菌株会同时增加对其他β -内酰胺类抗生素的不敏感率, 此外, 首选药物青霉素也有部分不耐受者, 若临床分离菌株出现青霉素耐药的同时又对其他抗生素不敏感, 无疑会对临床抗感染带来严重挑战, 因此, 发现和研究具有潜力的抗菌药物不可懈怠。在我们的实验中, 虽然只使用青霉素敏感的肺炎链球菌进行研究, 但LytA′ 潜在的抗菌价值已初步体现, 而且, LytA’ 的相对分子质量较小, 有作为抗菌药物的可能性。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|