作者简介:陈圆圆(1987—),女,硕士,主治医师,研究方向:感染性疾病。
慢性乙型肝炎(慢乙肝)感染是我国重大公共卫生问题, 其临床治愈是目前国内外最新慢乙肝防治指南推荐的理想治疗目标[1, 2, 3]。直接抗病毒药物和免疫调节剂序贯或联合治疗的优化方案是现阶段最可能实现临床治愈的有前景的治疗策略[4]。对治疗前乙肝病毒表面抗原(HBsAg)低水平(< 1 500 IU/mL)及治疗中HBsAg快速下降(12 周或 24 周时HBsAg< 200 IU/mL或下降> 1 lg IU/mL)的患者, 治疗后HBsAg阴转发生率较高[5, 6], 《慢性乙型肝炎防治指南》提及聚乙二醇干扰素α (PEG-IFN)有骨髓抑制的不良反应, 如中性粒细胞计数下降、血小板计数下降[3, 7], 但未提及血红蛋白下降; 聚乙二醇干扰素α -2b使用说明书不良反应中血红蛋白下降发生频率< 1%。近年来深圳市第三人民医院在聚乙二醇干扰素临床使用中发现2例出现严重贫血的病例, 且起病隐匿, 程度较重, 特此报告, 供各位同道借鉴。
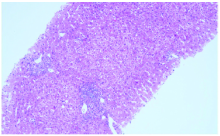
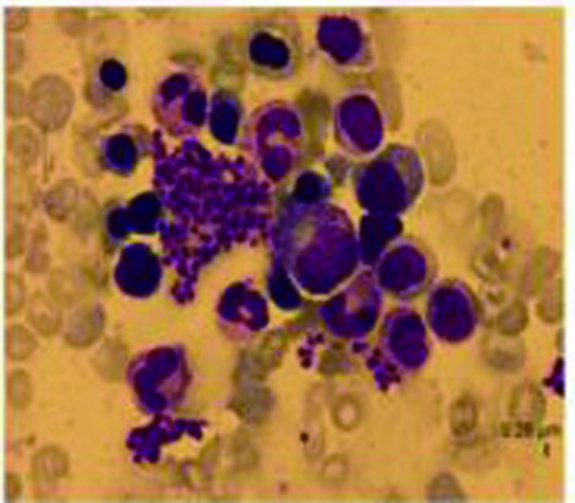
病例1, 李某某, 男性, 26岁。HBsAg阳性7年, 曾使用“ 阿德福韦酯” 抗病毒2年后自行停药。2020年6月于深圳市第三人民医院就诊, 查乙肝病毒表面抗原(HBsAg) 8 683.00 IU/mL, 乙肝病毒e抗原(HBeAg) 1 224.143阳性, 乙肝病毒c抗体9.57 阳性; HBV DNA 3.05× 107 IU/mL。谷丙转氨酶(ALT)69 U/L, 谷草转氨酶(AST)39 U/L, γ -谷氨酰转肽酶(GGT) 50 U/L。血红蛋白浓度(HGB) 117 g/L。B超检查为胆囊结石, 肝脏、脾脏及胰腺未见明显异常声像, 门静脉系统未见明显异常。肝实质声触诊弹性成像(STE)均值为13.03 Kpa。乙肝基因分型为C型。甲状腺功能正常, 抗肝肾微粒体1型抗体阳性。2021年6月23日行肝穿刺活检术, 病理诊断为慢性乙型病毒性肝炎(G1+/S2), 见图1。2020年7月4日 开始恩替卡韦+聚乙二醇干扰素α -2b(派格宾)135 µ g qw联合治疗, 7月11日加用重组人粒细胞刺激因子刺激白细胞、中性粒细胞生成。8月1日调整为聚乙二醇干扰素α -2b(派格宾)180 µ g。患者自2020年8月1日(第4周)开始出现血红蛋白逐渐下降, 2020年9月22日(第11周)下降至66 g/L, 无呕血、黑便, 遂加用琥珀酸亚铁治疗, 监测血红蛋白仍持续下降, 11月15日(第19周)下降至41 g/L, 遂住院治疗并停用干扰素。住院期间查粪便潜血阴性, 肾功能正常, 肝功能胆红素轻度升高, 间接胆红素轻度升高, 直接抗人球蛋白试验阴性, 尿液为淡黄色, 血红蛋白电泳:血红蛋白A、血红蛋白A2、血红蛋白F分别为90.7%、4.6%和4.7%, 考虑合并轻度地中海贫血。予输注红细胞悬液4 U, 复查血红蛋白升至70 g/L, 行骨髓穿刺术检查, 诊断意见:此部位骨髓增生活跃, 粒系比例正常, 红系比例明显增高, 巨核细胞数正常, 血小板易见, 考虑增生性贫血骨髓象, 见图2~3。请血液科会诊考虑药物相关性贫血, 停止干扰素治疗, 单用恩替卡韦抗病毒治疗。2021年5月15日复查血常规HGB:132 g/L。患者治疗及随访期间指标变化见表1。
| 表1 病例1治疗及随访期间指标变化 Table 1 Index changes of case 1 during treatment and follow-up |
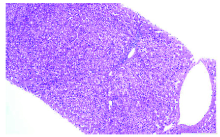
病例2, 严某某, 男性, 40岁。发现HBsAg阳性20余年, 使用“ 恩替卡韦” 抗病毒5年。2020年5月超声提示肝实质回声稍增粗, 2020年11月1— 3日于深圳市第三人民医院住院, 查HBsAg 707.12 IU/mL, 乙肝病毒e抗原阳性, 乙肝病毒c抗体阳性, STE 均值 6.9 Kpa。HBV DNA< 100 IU/mL。查甲状腺功能正常, 自身免疫性抗体阴性。2020年11月2 日行超声引导肝穿刺活检术, 病理诊断符合慢性乙型病毒性肝炎(G1/S2), 见图4。2020年12月5日开始恩替卡韦加用聚乙二醇干扰素α -2b(派格宾)180 µ g qw序贯联合治疗, 12月12日加用重组人粒细胞刺激因子、利可君刺激白细胞、中性粒细胞生成。患者自2021年1月29日(第8周)开始出现HGB逐渐下降, 3月3日(第13周)HGB下降至79 g/L, 无呕血、黑便, 肝肾功能正常, 加用琥珀酸亚铁治疗, 患者血红蛋白仍持续下降。4月3日(第17周)下降至68 g/L, 遂至血液科就诊, 予暂停干扰素。查血红蛋白电泳示血红蛋白A、血红蛋白A2和血红蛋白F分别为88.1%、5.7%, 和6.2%。予重组人促红素注射液(赛博尔) 10 000 U qw im, 1周后复查HGB升至78 g/L, 2周后升至93 g/L, 停用重组人促红素, 2021年5月3日HGB升至108 g/L。患者于2021年5月5日再次加用聚乙二醇干扰素α -2b(派格宾)180 µ g qw抗乙肝病毒治疗, 6月11日查血常规示HGB再次下降, 遂停用干扰素, 继续恩替卡韦抗病毒治疗, 2021年7月24日复查HGB上升至110 g/L。患者治疗及随访期间指标变化见表2。
| 表2 病例2治疗及随访期间指标变化 Table 2 Index changes of case 2 during treatment and follow-up |
慢乙肝临床治愈即完成有限疗程治疗后, 血清HBsAg和HBV DNA持续检测不到、HBeAg阴转、伴或不伴HBsAg血清学转换, 肝脏炎症缓解和组织病理学改善, 终末期肝病发生率显著降低, 对于适合的优势人群应尽可能追求早期临床治愈。李淑等研究发现聚乙二醇干扰素治疗HBsAg< 500 IU/mL慢性乙型病毒性肝炎患者HBsAg 清除率明显高于基线水平高者, 治疗过程中第24周HBsAg下降幅度可预测治疗48周时HBsAg清除率[8]。本报道中病例1发现HBsAg阳性7年, 持续肝功能异常, 肝穿刺提示慢性乙型病毒性肝炎, 轻度, G1+/S2, 患者慢性乙型肝炎诊断明确, 根据2019年版《慢性乙型肝炎诊疗指南》[3], 达到抗病毒治疗指征。对于抗病毒方案的选择, 患者基线HBsAg:8 683 IU/mL, HBVDNA 3.05× 107 IU/mL, 排除聚乙二醇干扰素治疗禁忌症, 根据2017年版《慢性乙型肝炎临床治愈-功能性治愈-专家共识》[9], 是PEG-IFN 抗病毒治疗良好的预测因素, 为实现临床治愈的目标, 此患者核苷类似物联合聚乙二醇干扰素为最佳抗病毒治疗方案。病例2 发现HBsAg阳性20余年, 是恩替卡韦经治患者, 基线HBsAg 707.12 IU/mL, HBVDNA< 100 IU/mL。肝穿病理结果符合慢性乙型病毒性肝炎G1/S2。对核苷类似物经治慢乙肝患者中符合条件的优势人群联合干扰素可使部分患者获得临床治愈[4, 10], 治疗前HBsAg低水平(< 1 500 IU/mL)的患者, 联合治疗后HBsAg 阴转的发生率较高[5]。该患者为临床治愈的优势人群, 且无干扰素治疗禁忌症, 为实现临床治愈的目标, 序贯联合使用聚乙二醇干扰素为最佳治疗方案。
本次病例1选择ETV+PEG-IFN α -2b联合抗病毒治疗方案, 在治疗第4周开始出现血红蛋白下降, 并呈进行性下降趋势, 予补铁治疗无效, 于第19周达到最低值41 g/L, 完善骨髓穿刺及血涂片检查, 血液科会诊考虑药物导致贫血, 暂停干扰素, 输注红悬液, 单用ETV抗病毒治疗, 监测血红蛋白逐渐上升至正常。病例2核苷类似物经治患者, 临床治愈优势人群, 序贯联合PEG-IFN α -2b后第8周开始出现血红蛋白进行性下降, 补铁治疗无效, 在治疗第17周达到最低值68 g/L, 停用干扰素及使用促红细胞生长素后可逐渐上升, 再加用干扰素出现再次下降现象, 停用后血红蛋白自行上升。根据我国药物不良反应因果判定方法[11], 诊断为PEG-IFN相关贫血。
这两个病例有一个共同特点, 都合并地中海贫血, 对于南方地区地中海贫血相对多见。杨子文报道12例有多次输血史的重型地中海贫血患者同时合并慢性丙型肝炎, 均能耐受干扰素α -2b, 300万单位, 皮下注射, 每周3次的治疗方案[12]。2018年EASL在《慢性丙型肝炎治疗推荐意见》提到, 对血红蛋白病患者不推荐使用PEG-IFN[13]。合并地中海贫血的慢乙肝患者是否适合干扰素治疗的问题, 由于我们目前病例数较少, 具有局限性, 有待后续相关研究证实。
聚乙二醇干扰素是抗病毒药, 同时也有免疫调节与抗肿瘤作用, 用于治疗慢乙肝, 其 HBeAg 血清学转换率、HBsAg消失率(临床治愈)、延缓与降低肝硬化及肝癌发生率均优于未经PEG-IFN治疗者, 因此, PEG-IFN为慢乙肝常用与优先选择的治疗药物之一[1]。以“ 乙型肝炎、干扰素、贫血” 为检索词在中国知网、万方数据及以“ interferon、hepatitis B、anemia” 为检索词在 PubMed 中搜索, 时间不限, 结果少有发现。我国 2014 年的《慢性病毒性肝炎患者干扰素α 治疗不良反应临床处理专家共识》[4]、 2019 版《慢性乙型肝炎抗病毒防治指南》[3]、2017 年《聚乙二醇干扰素α 治疗慢性乙型肝炎专家共识》[10]等提及有骨髓抑制的不良反应, 其中以中性粒细胞和血小板下降最为明显, 可能与IFN对骨髓祖细胞的直接抑制相关[5]。临床中出现急剧的中性粒细胞、血小板下降, 包括血红蛋白下降, 应考虑与IFN所致的自身免疫性溶血, 三系下降还应考虑再生障碍性贫血[14], 搜索相关文献也有干扰素至急性溶血的报道[15]。但此病例1虽间接胆红素轻度升高, 与干扰素使用之前类似, 无急性溶血临床表现及检查肾功能正常, 尿常规正常, 直接抗人球蛋白试验阴性, 遂排除急性溶血。病例2的肝、肾功能正常, 排除急性溶血。两例患者三系中血红蛋白下降明显, 并不涉及中性粒细胞及血小板, 行骨髓穿刺检查排除再生障碍性贫血。此病发病隐匿, 血红蛋白进行性下降, 干扰素治疗过程中补铁无效, 与相关医师对此不良反应不熟悉, 警惕性不高, 不能及时准确诊治也有一定关系。希望通过此病例报告提醒临床医师, 贫血可能为 PEG-IFN α -2b 治疗慢乙肝的一个严重不良反应, 治疗过程中应提高警惕, 加强随访, 注意筛查, 一旦发现, 密切随访, 对症处理, 必要时及时停药并进行相应的治疗。
利益冲突声明 所有作者声明不存在利益冲突
编辑:符式刚
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|