目的 探讨单纯疱疹病毒脑炎(herpes simplex encephalitis, HSE)中细胞因子/趋化因子谱的表达情况,确定差异表达的因子及其相关的生物信息学作用。方法 单纯疱疹病毒1型(HSV-1)接种于Vero细胞,Reed-Muench法测定病毒滴度;实验组小鼠鼻腔接种HSV-1,建立动物感染模型,观察至接种后第7 天,处死小鼠,左半脑制备石蜡切片用于病理学检测,右半脑制备脑组织匀浆用于观察其致Vero细胞病变作用及高通量细胞因子/趋化因子表达谱芯片检测。GO、KEGG和PPI等分析技术用于差异表达蛋白的生物信息学研究。结果 实验组小鼠接种HSV-1后几乎都出现了病毒性脑炎的症状(发病率为100%),7 d内15只小鼠中死亡3只(死亡率20%),而对照组小鼠均正常,但实验组动物的发病率和死亡率与正常对照组相比差异无统计学意义( P>0.05)。脑组织病理学检测发现实验组小鼠脑组织轻度水肿伴大量炎性细胞浸润,见少量出血灶,对照组小鼠脑组织正常。实验组小鼠脑组织匀浆接种Vero细胞后发现大量细胞脱落、融合,出现明显的细胞病变效应,对照组细胞无明显改变。脑组织匀浆经PCR扩增出了病毒UL36的基因片段,而对照组未扩增出。细胞因子/趋化因子芯片于实验组筛选出了7个差异表达蛋白,GO富集分析发现其涉及多个生物学过程,与炎性细胞的活化和趋化有关;KEGG 通路富集分析筛选出了7个有意义的信号通路,涉及TNF信号通路和NOD样受体信号通路等;PPI分析发现大多数差异表达蛋白组成了一个相互作用网络,其中IL-6、IL-1、IFN-γ和TNF-α是该网络的主要因子。结论 单纯疱疹病毒脑炎小鼠模型中筛选出了7种差异表达的细胞因子/趋化因子,和与之相关的信号通路可能参与了HSE的病理生理机制。
Objective To explore the differently expressed cytokines and chemokines and analyze the associated bioinformatic characteristics of the selected factors to understand the pathways that lead to herpes simplex encephalitis (HSE).Methods Vero cells were used for the titer determination of herpes simplex virus type 1 (HSV-1) by Reed-Muench method. Mice in the experimental group were inoculated intranasally with HSV-1 to establish the virus infected animal models and observed to the 7th day after inoculation. The mice were killed and the brain tissues were removed to prepare the paraffin sections with left cerebral hemisphere for pathological examination and brain tissue homogenate with right cerebral hemisphere for the cytopathic effects and cytokine chip assay. GO, KEGG, and PPIs analyses were employed to investigate the biological process (BP), pathways and interaction network of the differently expressed proteins (DEPs) in HSE mice.Results All of the animals suffered from HSE (100%) and three out of 15 mice died (20%) in the experimental group. However, all of the mice in control group were normal. Interestingly, there were no significant differences of the mortality and morbidity between the experimental group and the control ( P>0.05). Virus-infected brain tissues showed inflammatory damages such as edema, hemorrhagic lesions, and immune cell infiltration. Conversely, no lesions were found in the control. A large number Vero cells were abscission and fusion after inoculated by the brain homogenate separated from the experimental group mice, no changes were found in control group. The virus gene of UL36 was detected by PCR only in the homogenate in the experimental mice brain. Seven DEPs and various proteins-related signal pathways were identified in HSE mice. Multiple biological processes which mainly implicated in immune cell activation and chemotaxis were screened by GO analysis; seven signal paths were selected by KEGG, such as TNF signal pathway and NOD signal pathway, et al. The DEPs constituted a pivotal protein interaction network by PPI, and IL-6, IL-1, IFN-γ and TNF-α were the main factors in the network.Conclusion Seven DEPs and a series of related signal pathways are selected, which might associate with the pathophysiological mechanisms responsible for HSE.
单纯疱疹病毒性脑炎是一种后果严重的中枢神经系统感染性疾病, 据估计其发病率达1/250 000~ 1/500 000[1, 2], 是西方国家最常见的急性局灶性散发性脑炎。未经治疗的患者死亡率超过70%, 即使采用适当的抗病毒治疗, 仍有50%以上的患者发展成永久性神经系统后遗症[3]。尽管两种类型的单纯疱疹病毒(1型和2型)均可引起单纯疱疹病毒性脑炎(herpes simplex encephalitis, HSE), 但90%以上的患者是由1型引起的。
单纯疱疹病毒1型(HSV-1)是属于α 疱疹病毒科的双链DNA病毒, 初发感染多见于婴幼儿, 潜伏和复发感染以成年人为主[4]。常通过直接接触引起皮肤粘膜感染, 如唇疱疹、病毒性角膜炎、病毒性咽颊炎等, 其中病毒性角膜炎致盲率较高, 病毒性脑炎是该病原体引起的最严重感染, HSE的确切发病机制仍然不清楚, 越来越多的研究表明免疫反应介导的神经系统炎症损伤可能起关键作用[5]。
HSV-1感染机体后可诱导宿主细胞释放大量细胞因子/趋化因子, 进而诱导炎症反应, 促进病毒清除。然而, 这些炎性因子的过度表达往往引起过度的炎症反应, 可能会导致组织细胞损伤, 引起感染局部或全身病变[6, 7]。因此, 细胞因子/趋化因子的高表达可能在HSV-1的发病机理中起着关键作用, 并可能最终决定感染的结局。然而, 细胞因子/趋化因子与免疫细胞之间的作用极为复杂, 涉及了多种细胞和多条信号通路。而且, 细胞因子/趋化因子通常以协同的、拮抗的、网络的相互作用方式发挥作用。因此, 研究细胞因子/趋化因子在HSV-1感染中的生理和病理机制时, 同时检测这些因子的表达谱极为必要。而目前的研究主要集中在1种或几种细胞因子/趋化因子在HSV-1感染中的作用, 难以全面把握其功能。本研究拟通过高通量蛋白质芯片技术同时检测细胞因子/趋化因子谱在HSE小鼠的表达, 以便进一步探讨其在HSE中的作用。
1.1.1 动物和细胞 7周龄健康昆明种雄性小鼠30只(体重18~22 g), SPF级, 购于长沙天勤生物技术有限公司(许可证号SCXK(湘)2014-0011), 实验动物的使用与处置均遵守海南医学院伦理学委员会的要求。非洲绿猴肾细胞株(Vero cell line, Vero 细胞)购于中科院干细胞库(SCSP-520、CCL-81TM)。
1.1.2 主要试剂 RayBio® 细胞因子芯片购于广州瑞博奥生物科技有限公司, 病毒基因组DNA/RNA 快速提取试剂盒升级版(离心柱型) 购于北京百泰克生物技术有限公司。
1.1.3 主要仪器 生物安全柜(SG403A-HE)购于Baker公司, CO2培养箱(MCO-18AC)购于松下电器有限公司, 超声波细胞粉碎机(SCIENTZ-950E)和高通量组织研磨器购于宁波新芝生物科技有限公司, 高速冷冻离心机购于美国Beckman公司, 全自动凝胶成像分析仪(JY04S-3E)购于北京君意东方电泳设备有限公司。Image Quant LAS 4000扫描化学发光成像分析系统购于GE公司(美国)。
1.2.1 病毒滴定 HSV-1接种于已长成单层的Vero细胞中, 观察细胞病变情况(cytopathic effect, CPE)。当CPE达“ +++~++++” 时收获病毒, 用Reed-Muenc h[8]法滴定其半数组织感染量(50% tissue culture infective dose, TCID50)为105。本实验拟用100 TCID50病毒接种小鼠。
1.2.2 动物感染模型建立 30只雄性小鼠随机分为实验组和正常对照组, 每组15只。实验组小鼠经鼻腔接种0.5 mL 100 TCID50 的HSV-1悬液, 正常对照组用等量DMEM接种。接种后每天观察小鼠发病情况至接种后第7天, 对于死亡的小鼠, 立即取其脑组织, 预冷PBS冲洗, 左半脑立即于10%多聚甲醛中固定, 常规石蜡切片, HE染色, 镜检; 右侧半脑暂存于4 ℃备用。
1.2.3 脑组织匀浆致Vero细胞病变作用及HSV-1检测 两组动物在戊巴比妥钠麻醉下无菌取脑组织, 预冷PBS冲洗, 左半脑用于制备脑组织病理切片(同1.2.2)。右半脑用于制备脑组织匀浆, 取500 μ L 匀浆12 000 r/min(离心半径8.2 cm)离心15 min, 收集上清液, 取100 μ L与2 mL含5%胎牛血清的DMEM混匀后, 接种于已长成单层的Vero细胞中, 观察5 d内细胞病变情况。5 d后Vero细胞反复冻融, 3 000 r/min(离心半径8.2 cm)离心10 min, 取上清, 病毒核酸提取试剂盒提取病毒基因组DNA, PCR法检测病毒UL36基因, 引物根据文献[9], 序列为UL36F:5′ -TAC GTC CTC ACC GTC ATC AAC-3′ , UL36R:5′ -CGC CAA AAG GTG TAA ATG TG-3′ ; 反应体系为Taq PCR MasterMix 11.25 μ L, 上下游引物各0.5 μ L, ddH2O 6.75 μ L; PCR反应:94 ℃ 5 min, 94 ℃ 60 s, 53 ℃ 40 s, 72 ℃ 40 s, 72 ℃ 7 min, 共30个循环。取PCR产物8 μ L进行1%琼脂糖凝胶电泳, 紫外凝胶成像仪观察结果。
1.2.4 蛋白质抗体芯片检测 取1.2.3中制备的脑组织匀浆, 细胞裂解液裂解细胞并进行蛋白质定量后用于芯片检测。芯片检测严格按说明书进行。在孵育盒中加入2 mL 封闭缓冲液, 室温振荡孵育1 h。用抽液泵抽去封闭液后, 加入1 000 μ L样本(样品按 500 μ g/mL上样)。盖上盖子, 包上塑料薄膜, 4 ℃振荡过夜。抽去样品 , 每个孵育孔中加入2 mL的1× 洗液Ⅰ 温振荡洗膜4次, 每次4 min; 抽去1× 洗液Ⅰ , 加入1× 洗液Ⅱ 室温振荡洗膜, 洗膜4次, 每次4 min。每张膜加入1 mL生物素标记抗体, 室温孵育2 h; 洗涤后每张膜加入2 mL 1 000× HRP-链霉亲和素, 室温振荡孵育2 h, 洗涤。每张膜上加入500 μ L的检测液C和D(1∶ 1)的混合液, 缓慢摇动2 min, 立即用滤纸吸干。然后使用ImageQuant LAS4000 Scanner以高分辨率方式进行扫描。结果使用专用于此阵列的AAM-INF-1分析工具进行数据分析, 鉴定差异表达的因子。
1.2.5 聚类分析 对于聚类分析, 选择了R语言(V2.17版本)的热图包。通过Euclidean距离计算两个样本和两个类别之间的距离, 并使用最远邻法(Complete)进行聚类。
1.2.6 功能富集分析 为探讨筛选出的DEPs在HSE中的潜在功能, 对其进行了GO和KEGG分析, 即使用Annotation, Visualization and Integrated Discovery的生物信息学分析系统(DAVID, https://david.ncifcrf.gov/tools.jsp)的数据库进行分析。分析中选择了P< 0.05且因子富集数量≥ 3的相关生物学过程和信号通路进一步分析。此外, 在String数据库(https://string-db.org/)中对DEPs进行了蛋白质-蛋白质相互作用(PPI)分析, 其中“ minimum required interaction score” 选择“ highest confidence 0.9” 。
动物生存分析:用SPSS 26.0软件统计分析数据, 采用Fisher's精确概率法比较实验组和对照组的发病率和死亡率, 以P< 0.05为差异有统计学意义。差异表达细胞因子/趋化因子的筛选:芯片扫描获得的数据去除背景、芯片间数据规范化后用于显著性分析, 统计方法用Moderated t检验。结果包括(log2)fold changes、P值和调整后的P值, 逐个比对待检的蛋白质。差异表达的认定条件为P值或调整后的P值小于0.05, foldchange> 1.2或小于0.83 (绝对logFC> 0.263)。
接种HSV-1后, 实验组中几乎所有小鼠都逐渐发病, 表现为懒惰、食欲下降、竖毛、体重下降、抽搐和肢体麻痹等。在7 d监测期间, HSV-1感染组小鼠3只死亡(死亡率20%), 其余12只均出现了上述感染症状(发病率为100%), 而正常对照组小鼠均正常, 全部存活, 而实验组动物的发病率和死亡率与正常对照组相比差异无统计学意义(P> 0.05)。
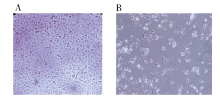
脑组织匀浆接种次日, 实验组少数细胞出现脱落, 对照组无变化, 接种第3天实验组细胞大量脱落、融合, 4~5 d达高峰, 对照组细胞未发现明显病变(图1)。脑组织匀浆提取病毒基因组DNA, PCR后发现了病毒UL36的基因产物(图2)。
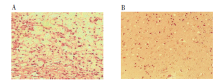
病理学检测发现实验组小鼠脑组织轻度水肿, 有大量炎性细胞浸润(淋巴细胞、巨噬细胞、中性粒细胞等), 局部可见少量出血灶; 对照组小鼠脑组织结构正常, 未见出血及炎性细胞浸润。见图3。
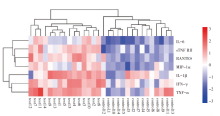
待测的40种细胞因子/趋化因子均可检测到, 但大多数因子在两组间的表达未发现差异, 只有7种符合DEPs的标准(表1)。与正常对照组相比, 实验组中所有差异表达的蛋白均上调。聚类热图可见两组间DEPs的不同表达模式(图4), 在同一组中差异表达的蛋白质表达方式相似, 而组间却不同。差异表达的细胞因子/趋化因子主要集中在白细胞介素家族(IL-1β 、IL-6)、肿瘤坏死因子家族(TNF-α 、sTNF RII)、CCL型趋化因子家族(CCL3和CCL5)及干扰素家族(IFN-γ )。
| 表1 HSE 组与对照组间的差异表达蛋白 Table 1 The differentially expressed factors between the HSE group and control |
基于筛选出的7个DEPs进行了GO富集分析, 发现这些蛋白共涉及39个生物学过程, 其中大多数与免疫应答、T细胞增殖的正调控、基因表达的正调控以及中性粒细胞趋化等有关。表2根据富集因子的数量(计数)列出了前10个结果, 其大小按降序排列。
| 表2 基于DEPs GO分析的主要结果 Table 2 The main enriched GO terms based on the DEPs |
7个DEPs的KEGG分析共筛选出了25条信号通路。其中有意义的结果为6个(表3), 可见富集因子最多的途径为细胞因子与细胞因子受体的相互作用(富集率100%), 其次为Toll样受体信号通路, TNF信号通路, 单纯疱疹病毒通路(富集率71.4%), 再次为NOD样受体信号通路(富集率57.1%), 最少的为胞浆DNA信号通路(富集率42.9%)。
| 表3 基于DEPs的主要KEGG信号通路 Table 3 The main KEGG signal pathways enriched with the DEPs |
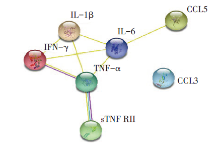
为进一步了解筛选出的DEPs相互作用网络, 我们使用STRING数据库对其进行了PPI分析。分析时, 选择Text mining, Experiments and Databases作为富集数据库, 并将Interaction Score设定为最大值0.9。结果表明, 大多数筛选出的DEPs出现了显著富集(P值为0.000 913), 除MIP-1-α (CCL3)外, 形成了一个蛋白质相互作用网络, 其中IL-6、IL-1β 、IFN-γ 和TNF-α 是组成该网络的主要因子(图5)。
HSV-1在人群中的感染率超过80%, 对婴幼儿、老年人及免疫力低下的成年人危害严重[10, 11, 12], 但其致病机理还未完全弄清楚。目前已知病毒感染机体后主要由宿主胚系基因编码的模式识别受体(PRR)识别病原体的病原相关分子模式(PAMP)引发抗病毒免疫, 诱导、激活多组细胞信号通路, 引起各种细胞因子/趋化因子的释放, 进而促进炎症细胞的活化和趋化, 介导炎症反应, 加速病毒清除改善病情, 而持续的炎性因子过度表达会通过细胞因子调节网络引起大量炎性细胞活化进而导致更高水平炎性因子分泌, 从而引起剧烈炎症反应, 引起组织细胞损伤[13, 14]。研究表明[15], TNF-α 、IFN-γ 、IL-6和IL-1β 等细胞因子在HSV-1感染的生理或病理机制中起着关键作用。因此, 监测这些细胞因子的表达对了解该病毒引起疾病的发病机理至关重要。本研究中, 通过鼻腔接种HSV-1建立了HSE感染模型, 采集感染后7d的脑组织, 通过高通量细胞因子/趋化因子芯片技术检测感染模型中细胞因子/趋化因子的表达水平。
结果表明, 实验组的所有动物均出现了中枢神经系统感染症状, 如疲劳, 反应迟钝、虚脱和抽搐、食欲下降等, 观察期内有3只动物死亡, 但死亡率与正常对照组相比, 差异无统计学意义(P> 0.05)。实验组动物脑组织匀浆接种Vero细胞后发现细胞出现了明显的病变效应, 提取病毒基因组DNA, PCR扩增后检测到了病毒UL36基因, 结合动物的临床症状说明病毒已在颅内建立了感染。病理学检测发现实验组小鼠脑组织有大量炎性细胞浸润, 轻度水肿, 少量出血, 而对照组小鼠脑组织未发现异常, 说明HSV-1感染导致了实验组小鼠脑组织的炎性病变; 蛋白芯片检测结果显示, 与对照组相比, 所有待测的40个细胞因子/趋化因子中实验组小鼠脑组织有7个出现了差异表达, 而且这些差异表达的因子均出现了表达上调, 未发现表达下调的因子。这些DEPs涉及多个细胞因子家族, 如白细胞介素家族(IL-1β , IL-6)、CCL家族(RANTES, MIP-1α )、干扰素(IFN-γ )和肿瘤坏死因子家族(TNF-α 和sTNF RⅡ ), 且大多数差异表达的蛋白属于炎症因子, 在募集和激活炎性细胞中发挥重要作用, 例如, IL-1β 和RANTES可促进炎性细胞浸润, IFN-γ 和MIP-1α 可激活单核/巨噬细胞, IFN-γ 和TNF-α 可促进T细胞活化和分化, 而IL-6可促进B细胞的活化和分化[16, 17, 18]。为进一步了解筛选出的DEPs在HSV-1感染中的潜在作用, 进行了GO、KEGG通路和PPI分析, 发现富集的通路和生物学过程几乎都与免疫调节、炎症反应、白细胞趋化和活化相关, 如Toll样受体信号通路、TNF信号通路、NOD-样受体信号通路、MAPK 和ERK1- ERK2级联信号过程等。当宿主细胞感染HSV-1时, 病毒蛋白或核酸(例如病毒相关的DNA和dsRNA)可以激活TLR介导的多个通路, 包括TNF信号通路和MAPK通路等, 这些信号通路的激活直接或间接介导白细胞介素和其他细胞因子的产生。推测该通路可能是宿主通过TLR对病毒dsDNA的识别所触发的, 并进一步诱导了信号分子的级联反应, 导致IL-1β 的产生, 亦或直接或间接通过MAPK途径诱导了IL-6和RANTES等的分泌, 其具体机制需进一步研究。STRING分析显示, 本研究中筛选出的7个DEPs除MIP-1-alpha外组成了一个相互作用网络, 可能在HSV-1炎症反应调节中起一定作用。但由于细胞因子/趋化因子的表达和作用极其复杂, 每一生物过程都可能涉及多个动态发挥作用的因子, 需动态监测才能全面了解这些因子的作用。另外, 本实验仅检测了40种细胞因子/趋化因子的表达, 并不能代表全部细胞因子/趋化因子的功能, 想要全面了解它们在HSV-1感染中的作用, 尚需进一步研究。
总之, HSV-1感染所致HSE触发了多个细胞信号通路的激活, 并导致了一系列细胞因子/趋化因子上调, 这可能有助于急性HSE病例中的病原体清除和/或加重脑组织炎症反应。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|