作者简介:李宾(1994—),女,在读硕士,研究方向:新型冠状病毒疫苗研究。
目的 鉴定携带新型冠状病毒S、N和M基因的疫苗在BALB/c小鼠上的T细胞表位。方法 用携带新型冠状病毒S、N和M基因的DNA疫苗和痘病毒载体疫苗免疫6~8周龄雌性BALB/c小鼠,末次免疫1个月内取小鼠脾细胞,用ELISPOT法检测其对新型冠状病毒特异性多肽的T细胞免疫反应,筛选出具有阳性反应的多肽片段,并对其表位进行预测分析。结果 S、N、M基因分别鉴定出12、2、17条阳性多肽。S基因中多肽S49、S50、S100、S101、S102、S103阳性反应率为100%,且免疫刺激指数最高;覆盖M蛋白全长的41条多肽中有7条能刺激50%以上的小鼠产生阳性反应。预测分析结果显示,S、N、M基因分别有10、1、16个MHC-1 H-2限制性表位,主要位于S基因的RBD区、N基因RBD区以及M基因的跨膜区。这些表位在SARS-CoV-2及其变异株、SARS-CoV中高度保守。结论 新型冠状病毒DNA疫苗和痘病毒载体疫苗诱导了针对多个基因、多个表位的特异性T细胞应答,未来通用型疫苗设计应包含能诱导细胞免疫的多个抗原,特别是包含保守表位的结构抗原。
Objective To identify the T cell epitopes of the COVID-19 vaccine carrying SARS-CoV-2 S, N and M genes in BALB/c mice.Methods Groups of 6-8 week-old female BALB/c mice were immunized with DNA vaccines and recombinant vaccinia virus carrying SARS-CoV-2 S, N and M genes. The spleen cells were harvested within 1 month after the last immunization, and the T cell immune responses to SARS-CoV-2 specific overlapping peptides were detected by enzyme-linked immunosorbent assay (ELISPOT) method. The peptides with positive reaction were screened out and MHC-1 restricted epitopes were predicted using NetMHCpan EL 4.1.Results S, N and M genes were identified 12, 2 and 17 positive peptides respectively. The positive reaction rate of peptides S49, S50, 100, S101, S102 and S103 of S gene was 100%, with the highest immune stimulation index. Among the 41 peptides covering the full length of M protein, 7 peptides could stimulate T cell responses in more than 50% of vaccinated mice. The prediction analysis showed that there were 10, 1 and 16 MHC-1 H-2 restricted epitopes in S, N and M genes respectively, which mainly located in the RBD region of S and N genes, and the transmembrane region of M gene. These epitopes were highly conserved in SARS-CoV, SARS-CoV-2 and its variants.Conclusions The COVID-19 DNA vaccine and recombinant vaccinia virus vaccine have induced SARS-CoV-2 specific T cell responses against multiple genes and multiple epitopes. The future universal vaccine design should contain multiple antigens that can induce cellular immune responses, especially the structural antigens containing conserved epitopes.
2019年底开始新冠疫情迅速席卷全球, 国际公共卫生进入紧急状态[1]。在不到两年时间, 全球已有超过2.4亿人感染, 超过490万人死亡(https://www.who.int/zh)。这是近20年来继严重急性呼吸系统综合征冠状病毒(SARS-CoV)和中东呼吸综合征冠状病毒(MERS-CoV), 第三次由冠状病毒引起的突发传染病。为控制新冠疫情, 各类疫苗先后被研制出来并在疫情防控中发挥着重要作用[2, 3, 4, 5]。然而, 新型冠状病毒变异迅速, 现有疫苗对变异株的保护效果有所下降。据研究, 针对英国突变株, mRNA疫苗接种者血清的中和活性下降200%~700%, 国产灭活疫苗总体保护率下降为59%[6, 7], 针对南非突变株腺病毒载体疫苗ChAdOx1对轻到中度新冠肺炎患者失去保护作用[8]。此外, 新冠疫情结束之后人类仍有可能面临新的冠状病毒威胁, 一种广谱的通用型冠状病毒疫苗是控制冠状病毒流行的希望所在。
冠状病毒感染产生的抗体在3~5年显著消减[9, 10], 而特异性T细胞可长期存在, 有研究显示感染者在恢复11后年仍可检测到记忆性T细胞[11, 12]。因此, 诱导针对保守表位T细胞免疫反应的疫苗才能有效应对冠状病毒变异。鉴于在T细胞表位研究中, 许多研究团队选择Bagg Albino (BALB/c)小鼠, 故本研究选择在BALB/c小鼠模型上, 鉴定本实验室构建的新型冠状病毒疫苗所含S、N和M基因的T细胞免疫表位, 为通用型冠状病毒疫苗的研制奠定基础。
1.1.1 肽库 新型冠状病毒S、N和M抗原肽库根据Wuhan-Hu-1(NC_045512.2)氨基酸序列设计, 由北京中科亚光生物科技有限公司合成。每条肽15个氨基酸, 相邻肽重叠10个氨基酸。S基因合成多肽234条(其中S1127条, S2 107条), N基因82条肽, M基因41条肽。
1.1.2 实验动物 6~8周龄SPF级BALB/c雌性小鼠购自北京维通利华实验动物技术有限公司(实验动物合格证号:No.110011210113243814)。动物实验场所为北京市芳元缘实验动物中心(许可证号:SCXK(京)2021-0006), 饲养环境温度18~22 ℃, 相对湿度40%~70%。动物实验伦理审查号:2020-CCDC-IACUC-007。
1.1.3 疫苗 新型冠状病毒DNA疫苗和痘病毒载体疫苗由本实验室构建。DNA疫苗p3.0-S、p3.0-N和p1.0-M分别表达新型冠状病毒S基因、N基因和 M基因, 痘病毒载体疫苗VTT-SN携带S和N基因。
1.1.4 主要试剂 RPMI培养基、青霉素-链霉素抗生素购自HyClone公司; 胎牛血清购自ExCell Bio公司; 红细胞裂解液购自Solarbio公司; 小鼠IFN-γ ELISPOT试剂盒购自BD公司。
1.1.5 主要仪器 高速冷冻离心机、HERAcell 150i GP二氧化碳培养箱购自赛默飞公司; 荧光ELISPOT读板仪购自德国AID Gmbh公司。
1.2.1 免疫程序 SPF级6~8周龄BALB/c雌性小鼠13只, 免疫方案见表1。组1在0、2周免疫DNA疫苗p3.0-S、p3.0-N, 5周加强免疫痘苗病毒载体疫苗VTT-SN。组2 采用肌肉注射辅以电穿孔(EP)的方式在 0、3周 免疫DNA疫苗p1.0-M, 即小鼠胫骨前肌注射DNA疫苗后进行体内电穿孔刺激。DNA疫苗免疫剂量为50 µ g/只, 痘病毒载体疫苗免疫剂量为5× 106PFU/只。
| 表1 新型冠状病毒DNA疫苗免疫方案 Table 1 SARS-CoV-2 DNA vaccine immunization programme |
1.2.2 小鼠脾细胞制备 小鼠颈椎脱臼处死后, 取脾脏研磨, 经红细胞裂解液处理和RPMI培养基洗涤后制备单细胞, 计数后调细胞浓度至5× 106cells/mL。
1.2.3 多肽配制 每管多肽干粉(1 mg)加入100 μ L DMSO配制成10 mg/mL的单肽母液。S基因234条多肽, 依次编号S1~S234。每10条肽混合为一个肽池, 共配制24个肽池, 依次命名S1-1~S1-13, S2-1~S2-11。N基因包含82条单肽, 依次编号N1~N82, 配制9个肽池, 依次命名N-1~N-9; M基因包含41条多肽, 依次命名M1~M41。S和N基因较长, 使用两步法鉴定阳性多肽, 即第一步先筛选出阳性肽池, 第二步再根据阳性肽池鉴定阳性反应单肽。M基较短则直接使用一步法鉴定阳性反应单肽。
1.2.4 IFN-γ ELISPOT免疫检测 小鼠IFN-γ ELISPOT试剂盒购自BD公司, 检测方法参照试剂盒说明书, 肽池与单肽工作浓度均为5 μ g/mL, 每孔加入5× 105个细胞, 每个肽池或单肽均做两个复孔, 同时设置未加肽刺激的阴性对照孔。AID ELISPOT读板仪读取斑点形成单位(spot forming nuits, SFUs)。阳性判断标准为:采用刺激指数(SI)进行阳性判定, SI=肽刺激孔SFU均数/阴性对照孔SFU均数。肽池刺激孔SI≥ 3为阳性, 单肽刺激孔SI≥ 2为阳性。
1.2.5 多肽的生物信息分析 使用IEDB Analysis Resource网页(http://tools.iedb.org/main/)的在线软件对S、N、M基因的阳性单肽进行T细胞表位预测和分析。采用NetMHCpan EL 4.1方法[13], 选择MHC限制性等位基因H-2-Dd、H-2-Kd、H-2-Ld, 长度为9个氨基酸, 预测表位与主要组织相容性复合体(MHC)的结合能力。在Immune Epitope Database (IEDB)查找已发表文献中与预测表位相似的表位。筛选标准为:序列匹配度为≥ 70%, 实验类型为T细胞研究, MHC-1限制性, 宿主选择人或鼠, 其余选择默认选项。
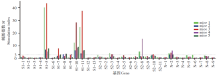
2.1.1 S基因与N基因阳性肽池鉴定 9个S抗原肽池, 1个N抗原肽池T细胞反应阳性, 其中S1-5、S1-10、S1-11肽池的刺激指数最高, 平均刺激指数分别为20.7、13.0和15.8。100%的小鼠产生了针对S1-5、S1-10、S1-11和N-2肽池的T细胞反应, 其余6个肽池的T细胞阳性反应率为20%~60%不等。阳性反应肽池主要分布于S基因的S1亚基。见图1。
2.1.2 S与N基因T细胞阳性反应单肽鉴定 S基因中12条多肽, N基因2条多肽反应为阳性。其中S49、S50、S67、S100、S101、S102和S103 阳性反应率为100%, 而S1亚基的S72、S85和S86, S2亚基的S152和S206, N蛋白的N17、N18多肽在部分小鼠中反应阳性。见图2。
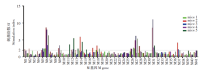
覆盖M蛋白全长的41条多肽中有7条能刺激50%以上的小鼠产生阳性反应, 分别为M5、M6、M12、M18、M26、M27、M31。还有10条多肽仅在个别小鼠刺激了阳性反应。见图3。
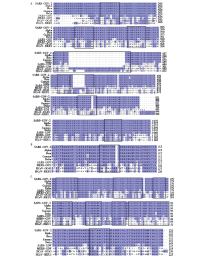
本研究筛选出S、N和M基因的阳性多肽共31条, 序列详见表2。用IEDB analysis resource NetMHCpan (ver. 4.1) tool逐一分析阳性多肽在BALB/c小鼠体内可能被识别的表位。分析显示, S基因有10个MHC-1 H-2限制性表位, 其中MHC-1结合力评分最高的多肽是S49, 其次为S100和S101, 以上多肽在小鼠实验中的刺激指数也最高, 软件预测表位分别是GYLQPRTFL和CGPKKSTNL, 表明该表位是显性表位, 具有强免疫刺激能力。多肽S102、S103的MHC-1结合力评分虽然< 0.1, 但在小鼠的刺激指数较高, 表位NRKRISNCV、NYNYLYRLF、YRLFRKSNL、VFAQVKQIY、SAPHGVVFL与MHC-1分子结合力较低, 刺激指数也偏低, 表明为非显性表位。
| 表2 新型冠状病毒S蛋白、N蛋白、M蛋白T细胞反应阳性肽 Table 2 T cell positive peptides of SARS-CoV-2 S, N and M protein |
N基因仅发现一个MHC-1 H-2限制性表位YYRRATRRI, MHC-1分子结合力评分0.414253, 人和小鼠均有此表位。M基因共发现16个MHC-1 H-2限制性表位, 其中AYANRNRFL与MHC-1分子结合能力较强, 在小鼠中平均刺激指数> 5, 说明该表位能刺激较强的细胞免疫。SYFIASFRL虽然预测与MHC-1分子结合能力较强, 但刺激指数较低, 且只有1/5小鼠反应。其他表位预测的结合能力均较低, 均是非显性表位。上述MHC-1限制性表位主要位于S基因的RBD区, N基因RBD区, 以及M基因的跨膜区, 少数位于S1的NTD、S2区或M的胞内区(图4)。通过比较高致病性冠状病毒(SARS-CoV、MERS-CoV、SARS-CoV-2以及变异株)、普通型人致病性β 属冠状病毒(HCoV-OC43、HCoV-HKU1)氨基酸序列, 我们发现这些表位在SARS-CoV-2及其变异株、SARS-CoV中高度保守(图5), 表明本研究使用的DNA疫苗/重组痘苗病毒载体疫苗诱导的T细胞免疫与多种新冠病毒变异株具有交叉反应。而MERS-CoV、HCoV - OC43和HCoV -HKU1的蛋白序列与新冠病毒差异较大。
 | 图4 MHC-1限制性表位 RBD. 受体结合域; HR. 七肽重复区; DD. 二聚结构域; TMD. 跨膜结构域。Fig. 4 MHC-1 restricted epitope RBD. Receptor-binding domain; HR. Heptad repeat; DD. Dimerization domain; TMD. Transmembrane domains. |
冠状病毒特异性T细胞在清除病毒、病毒感染细胞以及长期的免疫保护中发挥重要作用[14, 15]。SARS-CoV-2 感染引起的T细胞反应主要针对结构蛋白, 特别是针对M和N的T细胞反应与免疫持久性密切相关[16]。国内已批准使用的新冠疫苗中, 亚单位疫苗和腺病毒载体疫苗都仅含S或RBD, 灭活疫苗虽包含M和N蛋白, 但诱导CD8+ T细胞反应能力较弱。
本研究测试的新型冠状病毒DNA疫苗和痘病毒载体疫苗在BALB/c小鼠诱导了针对S、N、M基因的特异性T细胞应答, S、N、M基因分别有10、1、16个MHC-1 H-2限制性表位, 表明新型冠状病毒DNA疫苗和痘病毒载体疫苗可以诱导针对多个基因, 多个表位的CD8+ T细胞应答。通过比较文献报道的冠状病毒表位, 我们发现根据阳性反应多肽预测的MHC-1 限制性表位在新冠病毒感染者中均有报道[17, 18, 19, 20, 21, 22]。通过序列比对发现, 本研究中筛选出的表位在新型冠状病毒突变株中高度保守, 仅Delta 突变株M基因NWITGGIAI、IAMACLVGL表位有I82T突变。
M蛋白是冠状病毒颗粒含量最丰富的表面蛋白, 在冠状病毒颗粒组装过程中, M通过与其他结构蛋白相互作用, 促进病毒的出芽[23]。M蛋白具有很高的免疫原性, 可以同时诱导产生体液免疫和细胞免疫, 有研究发现CD4+Th细胞、CD4+T细胞针对M蛋白有更高反应[24], 所以M蛋白可以作为抗体监测和疫苗开发的目标。由于小鼠(MHC)与人(HLA)抗原提呈分子不同, 二者T细胞识别的表位有差异。尽管本研究发现的小鼠T细胞表位在人体中均有报道, 但人体对新冠抗原基因T细胞表位的识别还有待进一步更深入的研究。
新型冠状病毒不断变异, 感染病例也逐渐增加[25], 对公共卫生系统提出了巨大的挑战。包含多个抗原, 特别是包含保守表位的通用型疫苗可能是应对病毒变异的有效手段之一。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|