作者简介:符修昊(1997—),男,在读硕士,研究方向:病媒生物防控。
目的 为了探究埃及伊蚊多巴脱羧酶(dopa decarboxylase, DDC)基因在蚊卵发育过程中所发挥的功能。方法 首先通过荧光定量PCR技术构建DDC基因在埃及伊蚊中的时空表达谱,然后利用RNA干扰(RNAi)技术沉默埃及伊蚊成蚊DDC基因的表达,比较分析实验组与对照组的产卵量、卵孵化率和卵抗干燥能力。结果 DDC基因在卵时期表达量高于其他发育时期幼虫,在不同组织的相对表达量中,DDC基因在卵巢中转录本表达量水平约为胸部的5.35倍,是表皮和中肠的6.63倍和38.9倍。两个对照组间的产卵量和卵孵化率均无显著性差异(DEPC组产卵量和卵孵化率分别为122个/只蚊和95.1%;dsGUS组产卵量和卵孵化率分别为120个/只蚊和92.9%)。但实验组(dsDDC注射组)的产卵量(39个/只蚊)和孵化率(10%)均显著低于对照组( t=49.68, P<0.01)。在低湿度条件下(室温26 ℃,0~5%湿度),0~10 min之内,对照组蚊卵壳结构和饱和度基本无变化,而dsDDC组蚊卵壳结构出现坍塌,卵饱和度明显下降;30 min之后,dsDDC组蚊卵已脱水干瘪,而对照组蚊卵仍保持较高的饱和度。结论 基于以上结果,本研究初步推断DDC基因从埃及伊蚊卵的形成到发育过程起到重要的调控作用。
Objective To explore the role of Aedes aegypti DDC gene in development of mosquito eggs.Methods In this study, firstly, the spatiotemporal expression profile of DDC gene in Aedes aegypti was constructed by real-time quantitative PCR technology. And then, RNAi technology was used to interfere DDC gene of Aedes aegypti adults, and the egg production and egg hatching rate were statistically analyzed, and the anti-desiccation ability of eggs was compared and observed.Results The expression level of DDC gene in the egg stage was higher than that of larvae of other ages, and the relative expression level was the highest in different growth and development cycles. Among the relative expression levels in different tissues, the transcript expression level of DDC gene in the ovary was about 5.35 times that of the chest, 6.63 times and 38.9 times that of the epidermis and midgut. There was no significant difference in the number of eggs laid and the hatching rate of eggs between the two control groups (the number of eggs laid and the hatching rate of eggs in the DEPC group were 122 per mosquito and 95.1%, respectively; the number of eggs laid and the hatching rate of eggs in the dsGUS group were 120 per mosquito and 92.9%, respectively). However, the number of eggs (39 per mosquito) and hatching rate (10%) in the experimental group (dsDDC injection group) were significantly lower than those in the control group ( t=49.68, P<0.01). Under low humidity conditions (room temperature 26 ℃, 0-5% humidity), within 0-10 minutes, the eggshell structure and saturation of mosquitoes in the control group basically did not change, while the eggshell structure of the dsDDC group collapsed and the eggshell saturation after 30 minutes, the eggs of the dsDDC group were dehydrated and shriveled, and the eggs of the two control groups still maintained a high degree of saturation.Conclusion Based on the above results, this study preliminarily inferred that DDC genes play an important regulatory role in the process of Aedes aegypti egg formation and development.
蚊虫作为各种病毒的携带者与传播者, 对人类生命健康产生了严重的负面影响, 每年因蚊虫传播病原致死人数近百万例[1]。埃及伊蚊(Aedes aegypti)在我国分布主要集中在海南、广东、广西等地, 是城市型黄热病与登革热病毒的主要传播者。埃及伊蚊作为虫媒疾病传播的重要媒介之一, 逐渐引起科学家们的注意, 成为当今医学界重点防控的对象之一。在过去十年中, 全球埃及伊蚊传播登革热和寨卡病毒感染病例急剧上升[2, 3, 4]。由于化学杀虫剂的普及应用, 导致蚊虫的抗药性增强[5], 对环境的污染及人类的生活健康造成的潜在危险也不容忽视[6]。因此, 对埃及伊蚊寻求一种资源节约型、环境友好型的防治方法, 制定新的媒介控制战略迫在眉睫。埃及伊蚊的卵壳由不同类型的蛋白质组成, 包括结构蛋白、酶、气味结合蛋白和功能未知的未知蛋白[7, 8], 因此筛选出埃及伊蚊胚胎发育所必需的埃及伊蚊特异性蛋白很有必要。多巴脱羧酶(dopa decarboxylase, DDC)是一种吡哆醛-5-磷酸依赖性酶, 属于磷酸吡哆醛依赖的天冬氨酸转氨酶超家族(折叠I)[9]。可将左旋多巴转化为多巴胺[10], 多巴胺是硬化蛋白的重要底物[11]。DDC是埃及伊蚊卵绒毛膜鞣制的关键成分, 蚊卵绒毛膜的鞣制在酚氧化酶激活后开始, 然后催化酪氨酸羟基化为多巴, 并进一步将多巴和多巴胺氧化为他们各自的O-醌类。早期的一项研究表明, 当埃及伊蚊被丝虫入侵时, 埃及伊蚊体内防御反应有关的的黑色素包被可能占据大量酪氨酸, 导致卵巢中的酪氨酸减少, 这将延迟卵巢发育和产卵[12]。而dsDDC(注射DDC的dsRNA)处理过的卵绒毛在早期不能正常黑化, 因此不能完成胚胎发育, 导致其卵孵化率降低。昆虫与哺乳动物不同, 黑色素主要是由多巴胺合成的, 而多巴胺是由DDC产生的。在本研究中, 对埃及伊蚊DDC基因的特性和功能进行研究, 利用双链RNA(dsRNA)介导的基因沉默(RNA interference, RNAi)技术, 证明了RNAi沉默DDC会导致埃及伊蚊雌蚊产卵量的减少和孵化率降低, 并且发育过程中卵的抗干燥能力也会受到影响, 由于产卵量的减少和孵化率降低, 注射ds-DDC会导致埃及伊蚊繁殖力大大降低。
将埃及伊蚊的蚊卵放置于30 cm× 25 cm× 8 cm盛有水的饲养盆中, 在温度为(26±1) ℃、相对湿度为80%±5%, 光控周期(光照14 h, 黑暗10 h)下培养。待成蚊羽化后, 用8%浓度白砂糖糖水饲喂。在埃及伊蚊的生长周期中, 对蚊卵、1~4龄幼虫、白蛹、黑蛹、雄性成蚊、雌性成蚊进行收集。另外特别针对羽化后3 d的雌性埃及伊蚊, 在体视显微镜(Saikedigital, Shenzhen, China)下使用解剖针对其成虫进行组织解剖, 分别收集头部、胸部、附肢、表皮、卵巢和中肠等不同组织样品, 每个发育阶段以及每个组织收集3管做为生物学重复, 用于后续研究DDC基因在埃及伊蚊不同发育阶段、不同组织部位的表达情况。
为了研究Ae-DDC(GenBank登录号AAE L014238)在埃及伊蚊不同发育阶段、雌性成蚊不同组织的基因表达情况, 我们将收集到的埃及伊蚊每个发育阶段以及每个组织样本分组, 使用Trizol法进行总RNA的提取, 每组样本进行3次生物学重复实验。用PrimeScript™ RT试剂试剂盒(TaKaRa, 日本)去除基因组并反转录生成模板cDNA, 进行3次生物学重复实验。使用Primer 5软件设计DDC基因实时荧光定量PCR 引物(DDC-F:5'-CCTTTGTCTGTCCAGAATA TCG-3', DDC-R:5'-GTTCCTTCAGAGCCACATAGC-3' ), 用于扩增cDNA片段(产物片段大小为125 bp), 使用埃及伊蚊核糖体蛋白S17(RPS17)基因(GenBank登录号AAEL025999)作为参考基因。RT-qPCR在LightCycler 96仪器(Roche Applied Science, Mannheim, Germany)中进行, 反应体系(10 μ L)为:cDNA(10× ) 1 μ L, SYBR Green 4 μ L, qRT-Primer F 1 μ L, qRT-Primer R 1 μ L, ddH2O 3 μ L。RT-qPCR反应条件为:95° C预变性10 min, 95 ° C 10 s, 55 ° C 10 s, 72 ° C 30 s, 40个循环。在PCR反应结束时, 生成溶解曲线, 以评估PCR引物特异性。根据扩增的循环数(CT值), 采用2-Δ Δ ct方法对数据进行相对定量分析。使用Graphpad Prism 9对数据进行统计分析并绘制统计图, 后续RT-qPCR实验数据分析过程与此相同。实时荧光定量PCR反应完成后, 通过溶解曲线分析和1%琼脂糖凝胶电泳确定PCR产物的特异性。
用Trizol法(Invitrogen, 美国)提取埃及伊蚊雌蚊成蚊总RNA, 然后用PrimeScript™ RT试剂试剂盒(TaKaRa, 日本)去除基因组并反转录生成模板cDNA。使用Primer 5软件设计DDC基因的PCR 引物(DDC-F:5'-ACCTCAAGCCCCTTATCC-3' , DDC-R:5'-GCAAACCTGCTCGTTCTAC-3')并从cDNA中扩增出目的片段(产物片段大小为492 bp), PCR产物经1%琼脂糖凝胶电泳检测并回收纯化, 使用限制性内切酶XhoⅠ 、NotⅠ 将pL4440载体双酶切为空载, 再用T4 DNA连接酶将目的片段连接到具有T7聚合启动子的pL4440载体中, 组成目的片段和载体的重组质粒。将重组质粒转化到HT115 (DE3)感受态细胞中[13], 转移到LB培养基中, 37 ℃摇床过夜培养表达, IPTG终浓度为0.6 mmol/L。最后Trizol法提取表达的dsRNA(方法同上)并纯化, 1%琼脂糖凝胶电泳验证。
取孵化后3~5 d的埃及伊蚊雌蚊成蚊, 每次数量控制在300只左右, 注射180只, 多出的埃及伊蚊备用, 将注射后蚊子以及备用蚊子放入-20 ° C的冰箱中冷冻麻醉4 min。将冷冻麻醉的成蚊放入培养皿并置于冰上, 将DEPC水和dsGUS作为对照组, dsDDC作为实验组, 一共3组, 每组注射60只, 保证每组埃及伊蚊存活40只以上, 每组生物学实验重复3次。使用油压手动微量注射装置(Eppendorf AG, 汉堡, 德国)注射至冷冻麻醉后成蚊的胸腔内。在每只雌性成蚊胸腔侧面等量注射1 μ L, 称重判断注射量, 注射后将埃及伊蚊转移至蚊笼中饲养24 h后, 通过RT-qPCR检测DDC基因的转录水平, 进而评估注射后RNA干扰DDC基因效率。使用Graphpad Prism 9对数据进行统计分析并绘制统计图。
为了探讨DDC对埃及伊蚊产卵的影响, 将注入dsDDC的40只雌性成蚊与野生雄蚊(1雌2雄)进行交配。另外两组对照组同样处理。交配完成后, 将雄蚊取出, 将雌性埃及伊蚊转移至蚊笼中, 24 h后喂血。喂血后, 在雌蚊所在试管底部放入产卵纸, 观察其产卵量。将每只埃及伊蚊产卵纸转移至室温26 ℃, 相对湿度为90%±5%的盒子中进行保存, 将其放置3 d后拿出产卵纸进行孵化, 观察蚊卵孵化情况, 并统计孵化率。使用Graphpad Prism 9对数据进行统计分析并绘制统计图。
埃及伊蚊在室温(28±2) ℃, 湿度75%±5%的条件下饲养, 于产卵后第4天, 用水份检测器(型号MT-15)对湿度进行检测, 在保存产卵纸的盒子中(室温26 ℃, 湿度90%±5%), 借助小毛刷, 将卵从湿润卵纸(室温26 ℃, 50%±5%湿度)转移到干燥载玻片上(室温26 ℃, 湿度0~5%), 在脱水后的第2分钟和第10、20、30分钟利用显微镜观察记录, 对实验组和对照组的卵在同一显微镜视野下进行拍照, 并记录其干瘪情况。
采用Graphpad Prism 9进行处理数据并分析, DDC基因的荧光定量时空表达谱以及RT-qPCR检测干扰后DDC基因的相对表达量等数据处理采用t检验, dsDDC埃及伊蚊的产卵量采用Mann-Whitney rank sum test进行数据处理, dsDDC埃及伊蚊的卵孵化率采用χ2检验, 以P< 0.05为差异有统计学意义。
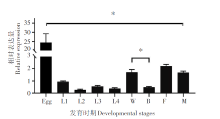
用RT-qPCR检测DDC基因在埃及伊蚊不同生长发育周期的相对表达量。时间表达谱转录本包括卵、幼虫、蛹、成虫等9个不同的发育阶段, 其中DDC在卵时期表达量显著高于其他发育时期幼虫, 差异有统计学意义(P< 0.01); 雌性白蛹表达量约是雄性黑蛹的3.46倍, 差异有统计学意义(P< 0.01); 雄性成蚊表达量高于雌性成蚊, 但差异无统计学意义(P> 0.05)。见图1。
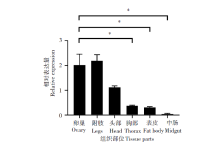
用RT-qPCR检测DDC基因在埃及伊蚊不同组织中的相对表达量。空间表达谱转录本包括成蚊的头部、附肢、胸部、表皮、中肠和卵巢共计6个不同组织。DDC在埃及伊蚊头部表达量高于胸和表皮, 胸和表皮阶段表达量基本一致, 而在中肠中表达量显著降低(图2)。DDC在卵巢中转录本表达量水平约为胸部的5.35倍, 差异有统计学意义(P< 0.01); DDC在卵巢中转录本表达量水平高于表皮和中肠, 分别是6.63倍和38.9倍, 差异有统计学意义(P< 0.01)。
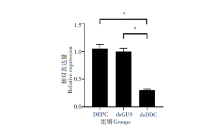
通过Real-time Quantitative PCR(RT-qPCR)对RNA干扰后实验组的埃及伊蚊和同一时期对照组的蚊虫进行检测, 得到DDC基因的相对表达量。结果显示, 同对照组(DEPC和dsGUS)相比, 实验组DDC基因的表达量降低了70%左右, 差异有统计学意义(t=9.839, P< 0.01), 而阴性对照组(dsGUS)与空白对照组(DEPC)之间差异无统计学意义(t=0.5588, P> 0.05)。见图3。
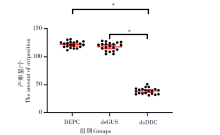
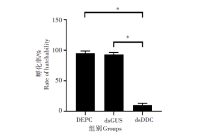
为了研究3组样本产卵量的变化情况, 使用RNAi沉默DDC基因后统计了3组样本产卵量的变化情况。结果表明, DEPC组和dsGUS组的产卵量分别为122个/只蚊和120个/只蚊, 两组产卵量基本保持在同一水平, 差异无统计学意义(t=1.996, P> 0.05); 而dsDDC组产卵量为39个/只蚊, 明显低于其他两组, 差异有统计学意义(t=49.68, P< 0.01)。见图4。
RNAi后3组样本卵孵化率的统计见图5, DEPC组和dsGUS组的卵孵化率分别为95.1%和92.9%, 两组间差异无统计学意义(χ2=0.866 3, P> 0.05), 而dsDDC组卵孵化率仅为10%, 明显低于其他两组, 差异有统计学意义(χ2=147.5, P< 0.01)。
在低湿度条件下dsGUS组的蚊卵在第10分钟蚊卵结构基本完好无损, 而在低湿度条件下dsDDC组蚊卵结构就已经基本坍塌。30 min时, 两组蚊卵饱和度具有明显差异, dsGUS组蚊卵饱和度依然很高, 而dsDDC组蚊卵已经出现严重失水, 明显干瘪的表型。见图6。
在埃及伊蚊中, 黑色素的生物合成是由酪氨酸羟基化为多巴开始的。多巴是黑化反应的一个分支点, 它可以被酚氧化酶(polyphenol oxidase, PO)氧化为多巴醌, 或被多巴脱羧酶脱羧为多巴胺。PO对多巴醌的进一步氧化产生多巴色素, 然后多巴色素通过多巴色素转化酶 (dopachrome conversion enzyme, DCE)在结构上重新排列并脱羧为5, 6-二羟基吲哚, 随后形成黑色素[14]。黑化作用在昆虫中具有重要的生理作用[15], 参与角质层鞣制、卵壳硬化、对病原体的防御反应以及伤口愈合等过程。在埃及伊蚊中, 新形成的蛹表皮是白色的, 0.5 h内变成黑色, 在含有多巴和酪氨酸酶的反应中迅速形成黑色素[16, 17]。有研究表明多巴胺对于昆虫生殖调控的机制是由其作为神经递质对下游受体进行激活进而产生一系列与生殖相关的级联反应[18], 并且多巴脱竣酶的下游产物多巴胺与昆虫卵巢发育的关系十分密切, 例如在蚂蚁 (Diacamma sp.)和黑腹果蝇 (Drosophila melanogaster)中, 雌性个体脑内多巴胺含量越高 , 其卵巢发育越好[19]。
埃及伊蚊每个卵巢大约有100个卵巢小管, 由初级卵泡、次级卵泡和一个生殖器组成, 卵泡在整个卵子发生过程中同步发育。昆虫卵壳是胚胎发育的重要保护层, 埃及伊蚊的卵泡发育和卵壳形成受到严格调控, 以应对血液摄取, 一旦雌性埃及伊蚊获得血液, 卵泡发育就会通过卵黄蛋白原的积累而启动[20, 21, 22, 23, 24]。蚊卵干燥抗性的时间与浆膜角质层的形成相关[7, 8]。蚊卵壳主要由毛囊细胞分泌的两层母体来源的绒毛膜和内绒毛膜层以及最里面的第三层(受精卵来源的胚胎外浆膜细胞在胚胎发生期间分泌的浆膜角质层)组成[14, 25], 浆膜角质层由许多排列整齐、紧密堆积、交替排列的电子致密和透明的水平板层组成[26]。卵壳绒毛膜黑化和硬化以及浆膜角质层的形成对包括伊蚊在内的几种蚊卵的脱水抗性很重要, 蚊卵表现出的抗干性有助于他们作为人类疾病的媒介在世界各地存活[27]。
本研究中来自dsGUS组和DEPC组处理的对照组埃及伊蚊蚊卵在低湿度条件下表现出高度的抗干燥性, 相反, 来自dsDDC处理的蚊卵中, 埃及伊蚊蚊卵表现出很低的抗干燥性, 在由湿润卵纸转移到干燥载玻片后, 经过0.5 h蚊卵发生崩塌, 内容物外泄。此外, 注射dsGUS和DEPC处理的对照组的埃及伊蚊有90%以上的卵能够正常孵化, 而注射dsDDC的埃及伊蚊产下的卵的卵孵化率明显下降, 孵化率仅有约10%。可能是因为当时很少或没有浆膜角质层, 或者内绒毛膜层, 多巴脱竣酶被抑制表达后 , 影响卵壳的硬化过程 , 可能导致卵失水, 卵抗干燥能力可能也会对卵孵化以及胚胎存活也有影响。dsGUS组和DEPC组的产卵量量基本保持在同一水平, 而dsDDC组产卵量明显低于其他两组。埃及伊蚊中存在一组DDC家族基因, 其转录水平在埃及伊蚊摄入血粉后立即在卵巢中上调, 说明DDC是参与卵黄生成和卵黄包膜形成的基因[28], 多巴脱竣酶可能调控埃及伊蚊卵母细胞到成熟卵粒的发育过程 , 进而参与对生殖力的调控。综上所述, 我们推断DDC在埃及伊蚊产卵、卵孵化和卵抗干燥能力方面发挥着重要的作用。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|