作者简介:杨雪娇(1995—),女,在读硕士,研究方向:旋毛虫免疫耐受性。
目的 研究旋毛虫重组抗原P53对小鼠骨髓来源的树突状细胞(DC2.4)吲哚胺2,3-双加氧酶(IDO)的表达及炎性因子分泌情况的影响。方法 设立实验组(旋毛虫重组抗原P53,终浓度为20 µg/mL)、阳性对照组(IFN-γ,来源于提高树突状细胞IDO表达的小鼠,浓度为1 000 U/mL)和阴性对照组(PBS),分别刺激细胞0、3、6、12、24 h后收集样品,利用qPCR技术对细胞内IDO、IL-10、IL-6、TNF-α的mRNA的转录水平进行检测;利用Western-blot方法检测各组IDO蛋白表达水平。进一步利用间接免疫荧光技术对细胞内的IDO进行检测。结果 qPCR结果表明,旋毛虫P53蛋白能引起胞内IDO、IL-10、IL-6及TNF-α的mRNA的转录水平增加,且呈现出时间依赖性。在24 h时,相比于阴性对照组,P53蛋白刺激组IDO及IL-6转录水平上调了5倍左右,抑炎因子IL-10 mRNA转录水平更是上调了9倍左右,TNF-α mRNA转录水平上调了7倍左右;Western-blot结果显示,旋毛虫P53蛋白刺激组和IFN-γ阳性对照组的细胞内IDO的蛋白表达水平均显著高于空白对照组,在刺激时间为24 h时相比于空白对照组上调了4倍;间接免疫荧光结果显示,旋毛虫P53蛋白刺激组相比于阴性对照组出现了明显的荧光。结论 旋毛虫重组抗原P53能够诱导树突状细胞IDO表达水平的上调,且呈现时间依赖性,可能与旋毛虫逃避宿主的免疫有一定关系。
Objective To investigate the effects of recombinant antigen P53 of Trichinella spiralison the expression of indoleamine 2, 3-dioxygenase (IDO) and secretion of inflammatory factors in mouse bone marrow-derived dendritic cells (DC2.4).Methods The experimental group - Trichinella spiralis recombinant antigen P53 (final concentration of 20 µg/mL), positive control group --IFN-γ (from mice with increased IDO expression of dendritic cells, concentration of 1 000 U/mL) and negative control group–PBS were constructed. Samples after 0, 3, 6, 12 and 24 h of stimulation were collected respectively. The mRNA transcription levels of IDO, IL-10, IL-6 and TNF-α were detected by qPCR; IDO protein expression levels were detected by Western-blot. IDO in cells was further detected by indirect immunofluorescence technique.Results qPCR results showed that P53 protein of Trichinella spiralis could increase the transcription levels of IDO, IL-10, IL-6 and TNF-α mRNA in a time-dependent manner. At 24 h, the transcription levels of P53 protein IDO and IL-6 were increased by about 5 times compared with the negative control group; the transcription levels of IL-10 mRNA and TNF-α mRNA were increased by about 9 times and 7 times respectively; Western-blot results showed that the expression level of IDO protein in spiralis P53 protein stimulation group and IFN-γ positive control group was significantly higher than that in blank control group, and the expression level of IDO protein in spiralis P53 protein stimulation group and IFN-γ positive control group was 4 times higher than that in blank control group at 24 h stimulation time; indirect immunofluorescence results showed that the P53 protein stimulated group of Trichinella spiralis showed obvious fluorescence compared with the negative control group.Conclusion In this study, recombinant antigen P53 can induce the up-regulation of IDO expression in dendritic cells in a time-dependent manner, which may be related to the immunity of Trichinella spiralis from the host.
旋毛虫病是一种全球性分布的食源性人畜共患寄生虫病, 严重危害公众健康和食品安全[1, 2]。旋毛虫的感染范围很广, 可以入侵150多种动物, 包括人类[3, 4]。因此, 有必要对旋毛虫致病机理以及免疫逃避机制进行深入研究。
研究发现, 树突状细胞(DCs)在诱导免疫耐受中起着重要的作用, 吲哚胺2, 3-双加氧酶(IDO)可以特异性表达在DCs上, DCs可通过上调IDO的高表达参与免疫耐受的形成。以往研究表明, 旋毛虫排泄-分泌(excretory-secretory, ES)抗原刺激树突状细胞导致IDO的产生明显升高, 参与免疫耐受的形成[5]。随着分子生物学技术的发展, 国内外研究者通过基因工程技术获得了旋毛虫基因重组蛋白用于免疫诊断, 已经取得了较好的进展, 而P53基因编码的蛋白是旋毛虫肌幼虫ES抗原的三种主要成分之一, 旋毛虫P53抗原是一种糖蛋白(基因登录号为U25127.1), 包含两个表位, 分别为肽表位和糖表位, 其生物学功能需要进一步探究。本研究成功体外表达纯化重组P53蛋白, 并将其体外刺激树突状细胞, 首次观察其对树突状细胞IDO及炎症细胞因子表达的影响, 为旋毛虫病的防控及其疫苗研制提供理论基础。
1.1.1 菌种 基因工程表达菌pET-32a-P53/BL-21由本教研室保存[6]。
1.1.2 实验细胞系 小鼠鼠源DC2.4细胞株购自中科院细胞库。
1.1.3 主要试剂及设备 重组小鼠γ 干扰素(rmIFN-γ )购自美国sigma公司, FITC荧光二抗购自美国Jackson公司, 超敏ECL显色液购自biosharp公司, 琼脂粉、DAPI染色液购自天津阿尔法生物科技有限公司, 庆大霉素购于大连美仑生物公司, 逆转录试剂盒、2× SYBR Green qPCR Master Mix购自南京诺唯赞生物科技有限公司, 琼脂糖购自西班牙Biowest公司, 兔抗GAPDH购自沈阳万类生物科技有限公司, Goat Anti-Rabbit IgG HRP(二抗)购自中国Abmart公司, 氯仿、丙三醇以及无水乙醇购自天津富宇精细化工有限公司, 1640培养液、青链霉素、RIP1裂解液(强)、5× SDS-PAGE蛋白上样缓冲液购于上海碧云天生物公司; ECL曝光仪是美国GE公司产品, 酶标仪是美国BioTek公司产品, 二氧化碳培养箱由美国Thermo公司(Thermo Forma 371)生产, 电泳仪及迷你双垂直电泳槽由北京六一生物科技有限公司生产, 荧光显微镜使用的是美国BioTek公司生产的仪器, 倒置显微镜是重庆奥特光学仪器有限责任公司产品。
1.1.4 重组蛋白的表达、纯化与复性 将重组菌pET-32a-P53/BL21在37 ℃、180 r/min条件下培养至对数生长期, 然后再加IPTG(终浓度为1 mmol/L)进行诱导, 37 ℃摇床继续培养7 h后4 ℃、9 000 r/min (离心半径8 cm)离心15 min, 收集沉淀用PBS溶液重悬后进行超声处理; 收集的蛋白(包涵体蛋白)需要先被8M Urea溶解, 再进行镍柱亲和层析、逐级洗脱、收集和电泳分析。镍柱与带有His标签的重组蛋白较好的结合, 经洗脱后可以得到纯度较高的蛋白[5]。收集的蛋白(包涵体蛋白)需要先被8M尿素溶解, 再进行镍柱亲和层析、逐级洗脱、收集后经SDS-PAGE电泳分析。将透析袋加热煮沸30 min, 根据SDS-PAGE电泳的结果, 将收集的重组蛋白洗脱液装入经处理的透析袋中, 并依次填充500 mL的6、4、2 mol/L尿素溶液和PBS溶液进行透析(4 ℃), 每次透析选择7 h以去除尿素并缓慢回收蛋白质。透析后的蛋白采用SDS-PAGE电泳进行分析[7]。
1.2.1 DC2.4的培养 将液氮中冻存的DC细胞置于37 ℃水浴中迅速融化, 1 000 r/min(离心半径6 cm)离心6 min, 弃去上清, 加入1 mL DC细胞培养基(90% DMEM+10% FBS)重悬细胞, 随后加入到细胞培养皿中, 并向皿中补充5 mL细胞培养基, 注意培养液需要提前复温, 水平摇晃培养皿使细胞均匀散开, 将培养皿转移到细胞培养箱中, 培养条件为37 ℃、5% CO2。待细胞状态良好并且密度达到80%后进行传代:首先吸弃皿中培养液, 加入磷酸盐缓冲液(PBS)洗涤四次, 加入1 mL胰酶在细胞培养箱中消化1 min, 使用移液枪轻轻吹打细胞使细胞脱离皿底并尽可能分散形成单细胞悬液, 加入2 mL培养基停止消化, 将细胞悬浮液以1 200 r/min(离心半径 6 cm)离心6 min, 弃掉离心后上清液, 然后添加培养基将细胞重悬起来, 按照1:4的方式进行分配传代。
1.2.2 DC2.4细胞分组及加旋毛虫重组抗原P53作用后细胞因子的RT-PCR检测 将状态良好DC2.4细胞接种于6孔板中(细胞浓度为1× 104个/mL), 20 µ g/mL 重组抗原P53刺激DC2.4细胞, 1 000 U/mL小鼠IFN-γ 刺激细胞作为阳性对照, 同时设空白对照组, 并在刺激0、3、6、12、24 h后, 分别收集各组细胞备用。按1.2.1的方法将细胞铺板并加入相应刺激物, 在刺激0、3、6、12、24 h后, 分别收集各组细胞。用Trizol试剂提取细胞总RNA, 反转录得到的cDNA作为模板分别检测各组细胞因子IDO、IL-10、IL-6、TNF-α mRNA表达水平。各个引物是按照GenBank所公布的基因序列而设计(表1), 登录号分别为IDO(NM_023973.1)、IL-10(NM_010548.2)、TNF-α (NM_013693.3)、IL-6(NM_001314054.1)、β -actin(NM_007393.5)序列, 其中β -actin作为内参基因, 上述引物均由库美生物科技有限公司合成。使用ChamQ Universal SYBR qPCR Master Mix试剂盒, 应用各自引物进行RT-PCR反应。所得的数据采用2-Δ Δ CT方法分析, 以确定IDO、IL-10、IL-6、TNF-α 的表达量。
| 表1 引物序列 Table 1 Primer sequences |
1.2.3 Western-blot法检测各组IDO蛋白表达量 收集各组DCs(1× 106个), 弃去培养基, 加入PBS清洗3次; 吸去PBS, 加入裂解液, 晃动培养皿使裂解液覆盖整个皿, 冰上裂解后离心收集上清, 用核酸蛋白测定仪测定样品蛋白总浓度并在SDS-PAGE电泳完毕后切下目的条带, 同时裁剪略大于目的条带的PVDF膜, 先通过甲醇浸泡活化, 再按照下层转膜滤纸、PVDF膜、目的条带、上层转膜滤纸的顺序依次放好, 随后转移到半干转膜仪上进行转膜, 转膜完成后将PVDF膜置于封闭液(即含5%脱脂奶粉的PBST)中, 室温摇床封闭2 h; 封闭完成后倒掉封闭液, 后以小鼠IDO单克隆抗体作为一抗(按照1:500稀释比例加入到封闭液中)过夜孵育, 小鼠GAPDH单克隆抗体稀释度为1:4 000(GAPDH蛋白作为内参)过夜孵育。洗涤后以HRP标记的山羊抗小鼠IgG为二抗(稀释比例为1:4 000)孵育2 h; 弃去二抗, PBST洗膜, 然后通过ECL发光试剂进行显影, 保存图像结果; 比较各组目的蛋白表达量, 每组实验重复3次。
1.2.4 免疫荧光检测IDO的表达 将状态良好的细胞以每孔1× 105平铺于12孔板上, 分别用旋毛虫重组抗原P53、PBS和小鼠IFN-γ 刺激细胞, 24 h后每孔用PBS洗3次, 每次6 min之后将细胞固定(4%多聚甲醛作为细胞固定剂), 室温固定后加入400 µ L 0.2% Triton-100进行细胞破膜, 之后封闭0.5 h, 封闭完成后直接加入配制好一抗IDO(1:300稀释于PBS中, BIOSS, 北京), 4 ℃避光孵育过夜; 次日用PBS洗3次后孵育二抗; 收集二抗后再用滤过的PBST洗涤2次, 加入DAPI(2 µ g/mL)复染5 min; 过滤后的PBST洗涤3次后, 向每个孔中加入400 µ L的PBS, 荧光显微镜检测, 所有实验重复3次。
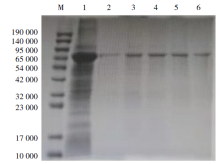
将重组菌在IPTG 终浓度为1 mmol/L、37 ℃进行诱导, 6 h后进行SDS-PAGE电泳出现目的条带, 经Ni-NTA柱纯化后出现单一的目的条带, 结果表明重组蛋白P53在大肠杆菌中获得表达并且纯度比较高(图1)。
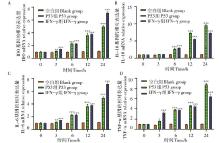
IDO及炎性因子IL-10、IL-6、TNF-α 的表达量分析结果显示(图2), 与空白对照组相比, 重组P53蛋白刺激组DC2.4细胞IDO的表达量逐渐增多, 呈时间依赖关系, 刺激3 h后IDO的表达量相比于对照组即开始上调。IFN-γ 刺激组也出现了类似的结果(P< 0.01, P< 0.001), 见图2A; 重组P53蛋白刺激细胞6 h后显著上调IL-10 mRNA表达水平(P< 0.001), 此时IFN-γ 组IL-10 mRNA表达水平也显著升高(P< 0.001), 两者之间差异不显著, 而空白对照组却没有出现明显变化(图2B); 旋毛虫重组P53抗原刺激组、IFN-γ 刺激组都能促进IL-6的表达, 与空白对照组差异显著(P< 0.01, P< 0.001)(图2C); 旋毛虫重组抗原P53迅速上调DC细胞中TNF-α mRNA表达水平且与时间呈正相关(P< 0.001), IFN-γ 刺激组在刺激3 h后即显著上调TNF-α mRNA表达水平(P< 0.001), 而空白对照组则几乎没有表达(图2D)。
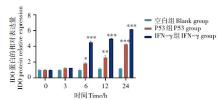
采用Western-blot方法对经旋毛虫重组抗原P53作用后DC2.4细胞IDO的表达量进行分析。结果显示(图3~图4), 重组P53抗原刺激组与空白对照组相比, IDO的表达量逐渐增多并呈时间依赖的关系, 刺激24 h后DC2.4 IDO表达量达到最大并且与空白对照组相比有显著性差异, IFN-γ 刺激组也有类似作用, 而空白对照组细胞则几乎没有IDO蛋白的表达。
 | 图3 Western-bolt检测DC2.4中IDO的表达水平 A. 空白组; B. P53组; C. IFN-γ 组。A. Blank group; B. P53 group; C. IFN-γ group.Fig. 3 The expression levels of IDO in DC2.4 by Western-bolt |
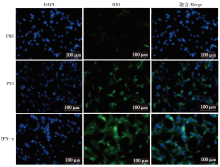
采用间接免疫荧光方法对经旋毛虫重组抗原P53作用后DC2.4细胞IDO的表达量进行分析。结果显示(图5), 经旋毛虫重组抗原P53刺激24 h后DC2.4细胞胞质中出现了明显的绿色荧光、IFN-γ 组细胞也出现了绿色荧光, 进一步说明旋毛虫重组抗原P53能够促进DC2.4细胞IDO的表达。
在世界大部分地区, 旋毛虫属(Trichinella spp.)已被发现是人类旋毛虫病的病原体, 旋毛虫病不仅影响人体健康, 而且是影响动物生产和食品安全的一个经济问题。目前对于旋毛虫免疫机制的研究大多为排泄分泌抗原(ES抗原)的研究, 但是ES抗原的大量标准化生产存在一些困难, 随着国内外学者的不断探究, 发现旋毛虫重组蛋白也可用于免疫诊断并且取得发展, 而P53蛋白作为ES抗原三种重要成分之一, 对于探究旋毛虫致病机理有重要的意义; 树突状细胞在调节和引发机体的免疫反应中发挥着重要的作用, 能够刺激初始T细胞的活化和增殖, 从而激发生物体的免疫应答。吲哚胺2, 3双加氧酶(IDO)是色氨酸(Trp)降解的犬尿氨酸(Kyn)途径的第一个限速酶, 广泛的研究表明, IDO与感染、自身免疫和过敏性疾病、癌症、移植和动脉粥样硬化有关[8, 9]。在炎症驱动的病理生物学机制背景下, IDO活性的损害加剧了潜在的炎症病理, 而这种缺陷的逆转导致了炎症改善[10, 11]。抗原提呈细胞(如巨噬细胞和DC)表达IDO, 能够抑制T细胞增殖, 是机体天然存在的免疫抑制机制[12]。
Western-blot结果显示, DC2.4细胞经过旋毛虫重组抗原P53刺激后IDO表达量显著上调并呈时间依赖关系, 而IDO本身就是一种免疫抑制分子, 过量表达可以使免疫细胞周围色氨酸过度降解从而影响免疫反应, 如色氨酸对T细胞的增殖分裂具有重要意义, 色氨酸缺乏时会引起T细胞增殖周期停滞并且其下游代谢产物可介导抗炎以及耐受机制, 这一结果表明旋毛虫重组抗原P53可能通过上调IDO的表达逃避生物体的免疫反应。
RT-PCR结果显示, 旋毛虫重组抗原P53引起炎症因子IL-6、IL-10和TNF-α mRNA水平的增加, 一段时间内呈时间依赖关系, DC通过释放高含量的IL-6、IL-10, 可能激活TH2型免疫应答, 并且在0~24 h时间梯度内, IDO mRNA的表达水平与时间呈正相关。最近, 一项研究发现树突状细胞分泌IL-10来维持树突状细胞IDO的表达[13]。TNF-α 可以促进DC分化成熟, 并调节DCs的抗原提呈作用, 过高浓度的 TNF-α 介导所有 DCs成熟而使之抗原摄取能力消失, 从而出现免疫抑制作用[14, 15], 这一结果表明旋毛虫重组抗原P53不仅会影响到免疫抑制分子IDO的表达, 而且还可能通过影响DC细胞炎性因子的分泌逃避机体的免疫反应达到寄生目的。
综上所述, 本研究建立了旋毛虫重组抗原P53和DC2.4细胞互作的体外模型, 发现DC2.4细胞在旋毛虫重组抗原P53刺激后显著上调IDO的表达并且引起几种细胞炎性因子mRNA表达水平的升高。本研究将更好地完善旋毛虫病免疫机制的有关内容, 为阐明免疫应答及免疫调节的机制提供依据。为旋毛虫病的防治工作提供了大量的理论资料。但旋毛虫重组抗原P53引起IDO增加之后是否还会影响到DC细胞成熟度?ES抗原其他两种重要组成成分是否也有类似效果?这都需要我们进行下一步的探究。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|