作者简介:安丽萍(1996—),女,在读硕士,研究方向:病媒生物学。
目的 对野外采集的蜱进行形态学与分子生物学鉴定,确定种属并完成该蜱的实验室人工饲养,研究该蜱虫的生物学特性及其对宿主的影响。方法 在体视镜显微镜下观察蜱的形态学特征,并结合分子生物学的方法扩增蜱虫线粒体 16srRNA目的基因,进一步确定蜱的种属;利用改进的实验室人工蜱喂养系统在新西兰白兔体表寄生蜱虫,分析其各时期的形态学变化和生活史特性,最后用全自动血细胞分析仪测定寄生与未寄生新西兰白兔血液的14项血常规指标。结果 根据蜱形态学分析,雌雄蜱的假头基呈六角扇形,腹部肛沟明显,雌蜱腹部可看到明显的生殖孔和肛门,具有明显的缘垛;PCR扩增 16srRNA 1.5%琼脂糖凝胶在约460 bp处有目的条带,确定野外采集蜱为血红扇头蜱( Rhipicephalus sanguineus)。在相对温度28 ℃,相对湿度(90±5)%的实验室环境下,血红扇头蜱发育1个完整的世代需要61~83 d,并表现出宿主单一性,即在不更换宿主的情况下,幼蜱、若蜱和成蜱均在新西兰白兔上寄生; 新西兰白兔寄生蜱6次后,体质量和体温降低,白细胞数(WBC)、淋巴细胞百分比率(LYM)等升高。结论 在相对温度28 ℃,相对湿度(90±5)%的实验室环境下,血红扇头蜱完成一个世代的发育需要61~83 d,并且寄生后新西兰兔表现出体质量体温降低,有炎性感染、轻度脱水和贫血症状。
Objective To identify the tick collected in the field by morphology and molecular biology, determine the species and complete the artificial breeding of the tick in the laboratory, and optimize the traditional artificial breeding method of ticks.Methods The morphological characteristics of the ticks were observed under a stereoscopic microscope, and the tick mitochondrial 16srRNA target gene was amplified by the method of molecular biology to further determine the species of the tick. The ticks were parasitized on the surface of New Zealand white rabbits by an improved laboratory artificial rearing method, and the ticks in different periods were analyzed. An automatic blood cell analyzer determined morphological changes, life history characteristics, and finally, 14 blood routine indexes of New Zealand white rabbit blood before and after parasitism.Results According to tick morphological analysis, the pseudo head base of male and female ticks is hexagonal fan-shaped, and the abdominal anal groove is obvious. The female ticks have obvious genital pores and anus in the abdomen, with obvious border stacks; PCR amplification of 16srRNA 1.5% agarose gel glue has a purposeful band at about 460 bp, which confirms the wild-collected tick as Rhipicephalus sanguineus. In the laboratory environment with a temperature of 28 ℃ and relative humidity of (90±5)%, Rh. sanguineus developed a whole generation. It takes 61 to 83 days and shows host monogeneity; without changing the host, larvae, nymphs, and adult ticks all parasitize New Zealand white rabbits; The number of white blood cells (WBC) and the percentage of lymphocytes (LYM) increased.Conclusion In a laboratory environment with a relative temperature of 28 °C and relative humidity of (90±5)%, it takes 61-83 days to complete a generation of development, and New Zealand rabbits show a decrease in body weight and body temperature after parasitism, which is inflammatory symptoms of infection, mild dehydration, and anemia.
血红扇头蜱(Rhipicephalus sanguineus)隶属节肢动物门(Arthropoda), 蛛形纲(Arachnida), 蜱螨亚纲(Acari), 寄螨总目(Parasitiformes), 硬蜱科(Ixodida), 扇头蜱属(Rhipicephalus), 常寄生于脊椎动物体表, 为三宿主蜱[1], 体内携带多种原虫和微生物, 包括犬埃立克体(Ehrlichia canis)、立克次氏体(Rickettsia)、支原体(Mycoplasma)及巴贝斯虫(Babesia microti)等[2]。并有经卵垂直传播病原体的能力, 对人类健康及畜牧业造成了重要的影响[3, 4]。血红扇头蜱在寄生后会导致宿主贫血、消瘦、发育不良及伤口处继发性细菌感染, 严重时会导致宿主瘫痪和死亡等[5]。血红扇头蜱的活动季节一般在夏季, 雌蜱一生可产卵1 000~3 000颗[6]。在附着动物体表摄食几天后, 蜱类与宿主之间发生复杂的相互作用, 几乎不可能用人工膜饲养完全复制。有研究结果表明, 地理环境在蜱的系统发育过程中起着重要的作用, 特别是其与宿主的关联起着重要的作用[7]。海南属于热带地区, 常年温度湿度适宜血红扇头蜱的生长与发育。因此, 为了进一步研究寄生蜱与宿主之间的致病机制以及药物的药效评价, 就需要有一套完整的动物疾病模型。在本研究中, 我们针对具体应用并改进的蜱喂养系统进行蜱类形态学、生活史特性及宿主血常规分析研究, 旨在为后续的药理学研究与抗蜱疫苗研发提供依据。
在海南省海口市流浪动物收容中心采集狗身上的蜱虫378只。
根据中国禽畜外寄生虫形态分类[8]中给出的形态学描述, 对比体视镜( SAIKEDIGITAL )拍摄的蜱虫形态学图片, 初步确定该蜱的属。
1.3.1 基因组DNA提取 用70%的酒精对蜱虫体表进行清洗消毒, 再用无菌水清洗3次, 利用Ezup柱式动物基因组DNA抽提试剂盒(上海生工)对蜱虫样本进行基因组DNA的提取, 具体的操作步骤参考试剂盒说明书进行。
1.3.2 常规PCR扩增目的基因 使用16srRNA引物扩增目的基因, 使用参照文献[9]中所用的引物序列, 上游物F:5′ -CTGCTCAATGATTTTTTAAATTGCTGTGG-3′ , 下游引物R:5′ -CCGGTCTGAACTCAGATCAAGT-3′ , PCR扩增反应体系为 50.0 μ L, 其中有2× Es Taq MasterMix 25.0 μ L, 上、下游引物(10 mmol/L )各1.0 μ L, 模板 DNA 2.0 μ L, 灭菌双蒸水 21.0 μ L。PCR 反应条件:94 ℃预变性 4 min; 94 ℃变性 30 s, 58 ℃退火30 s, 72 ℃延伸 30 s, 35个循环, 72 ℃延5 min。扩增产物于1.0%琼脂糖凝胶中电泳检查目的基因扩增结果。使用胶回收试剂盒纯化较亮的目的基因条带, 胶回收步骤按照上海生工生物工程有限公司所提供的试剂盒说明书进行。
1.3.3 转入受体细胞并纯化测序 将胶回收的产物与PMD18-T VECTOR载体链接, 连接产物转化至大肠杆菌DH5α 感受态细胞, 并在含氨苄青霉素的固体培养基上进行阳性克隆筛选。挑取阳性菌落, 在含有氨苄青霉素的液体培养基中培养12~16 h, 吸取菌液并进行菌落PCR反应, 用1%的琼脂糖凝胶电泳检查扩增片段的完整性, 将阳性质粒的PCR产物送至生工生物工程(上海)有限公司进行测序。
1.3.4 序列比对以及系统发育进化树的构建 将检测出的序列提交至NCBI数据库进行Blast比对, 确保检测出的序列是目的序列。同时从GeneBank中获得10种蜱编码的16srRNA的基因序列, 并将真螨目疥螨科的人疥螨作为外群, 在MEGA-X中利用最大似然法(maximum likelihood)构建进化树, 参数设置1 000的bootstrap test分析以保证树上每个节点的准确性。
用剪刀将EVA泡棉剪为中空方形, 在一端用折耳胶水将纱布粘在泡沫塑料上; 剃去兔背部部分毛发, 用胶水将泡沫塑料盒粘在剃去毛发的兔皮肤表面。实验过程中将整个盒子固定在兔背部皮肤上。选取生命力旺盛, 未饱血的成蜱放入盒中。每日打开观察蜱的吸血情况, 在蜱虫饱血后, 用毛刷将蜱刷下, 置50 mL大离心管中, 在相对温度(27.5± 0.5) ℃, 相对湿度(90± 5)% 的恒温培养箱中进行培养; 记录成蜱从宿主脱落到产卵的时间、卵孵化的时间以及卵的特征。
为了探索血红扇头蜱对宿主的致病性, 在新西兰白兔(n=6)体表寄生饥饿雌蜱(n=20)为寄生组(J1), 未寄生血红扇头蜱的新西兰白兔作为对照(J0), 利用全自动血细胞分析仪测定寄生组与未寄生组的宿主血样, 并对各项指标进行统计分析, 最后比较新西兰白兔体质量和体温的变化。
本次实验动物的使用由海南大学动物伦理委员会(第HNUAUCC-2021-00095号)审查和批准。严格遵守海南大学实验动物福利伦理相关法规和各项规定, 同意接受动物伦理委员会和实验动物室管理者的监督与检查。
雌雄蜱形态学差异明显。雄蜱的整个盾板覆盖背部, 假头基呈六角扇形(图1A); 腹部肛沟明显, 4对足大小均匀, 基节明显(图1B)。而雌蜱为了吸血后期的表皮发育, 盾板只覆盖背部1/3, 假头基呈六角扇行(图1C); 雌蜱腹部可看到明显的生殖孔和肛门, 缘垛明显(图1D); 初步鉴定为硬蜱科(Ixodida)、扇头蜱属(Rhipicephalus)中的血红扇头蜱(Rhipicephalus sanguineus)。
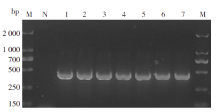
PCR扩增16srRNA 1.5%琼脂糖凝胶结果显示, 约460 bp处有目的条带(图2), 条带大小与预期的目的片段相符, 再一次验证了采集的蜱虫为血红扇头蜱。
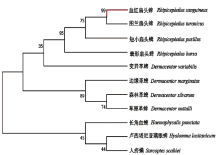
将序列提交至NCBI中进行同源序列比对。结果与血红扇头蜱的16sRNA基因片段相似度为100%, 验证了形态学鉴定结果。用MAGAX绘制系统发育树。从图3可知, 所选外群与内群各分一支, 测定的血红扇头蜱与其他蜱类如图兰扇头蜱、短小扇头蜱、囊形扇头蜱以及变异革蜱在同一个分支上, 其中, 血红扇头蜱与图兰扇头蜱的亲缘关系最近, 可信度为99%。
2.4.1 血红扇头蜱的生活史周期 从表1可知, 卵经过7~10 d孵化成幼蜱, 幼蜱经过2~3 d完成吸血前期并进入吸血期, 大约4~5 d后饱血并脱落。脱落后的幼蜱放入培养箱继续进行4~8 d的蜕皮。由幼蜱发育至若蜱的总时间为10~16 d。若蜱吸血前期为2~3 d, 吸血期为4~5 d。若蜱经过12~16 d的蜕皮成长为成蜱, 总时间为18~24 d。成蜱在经历4~5 d的吸血前期(雌雄交配阶段)后, 进入12~14 d的吸血期, 雌蜱产卵持续10~14 d, 产卵7 d后死亡。血红扇头蜱经过人工饲养完成一个世代周期的总时间为61~83 d。取1只成体雌蜱所产的1 000只卵, 由卵发育成幼蜱后, 成功蜕皮的幼蜱计数为527只, 完成吸血期的幼蜱为520只。蜕皮为若蜱的个体数为137只, 完成吸血期的若蜱为134只。蜕皮为成蜱个体数为60只, 其中雌蜱为38只, 存活率为6%。
| 表1 各时期蜱虫数量及发育天数 Table 1 Number and development days of ticks in each period |
2.4.2 卵 卵整体似椭圆形或圆形, 刚产出的卵四周颜色较深, 向中间逐渐变浅, 呈深棕色(图4A~图4B), 发育7 d左右时, 卵四周逐渐透明, 颜色变浅, 并且向内部逐渐延伸, 最终卵整体变为灰白色(图4C)。
 | 图4 血红扇头蜱卵的形态(A× 30, B、C× 40) A. 产卵的雌蜱; B. 卵; C. 发育一周后的卵。Fig. 4 Morphology of the eggs of Rh. Sanguineus (A× 30, B, C× 40) A. Female tick laying eggs; B. Eggs; C. Eggs after one week of development. |
2.4.3 幼蜱 刚孵化出的幼蜱整体呈白色, 2~3 d后, 体前端逐渐变为深褐(黄)色, 体后端变为浅黄色接近透明。背部不能观察到较为明显的盾板区域, 尚未观察到六角形假头基, 具三对半透明足, 缘垛在体视镜下清晰可见, 表面光滑。雌雄特征尚不明显, 无法分辨。幼蜱活动迅速且活跃。饱血后的幼蜱呈深红色, 躯体膨大, 饱血幼蜱在4~8 d后蜕皮成为若蜱。见图5。
 | 图5 血红扇头蜱幼蜱的形态(40) A.孵化的幼蜱; B.饱血的幼蜱; C.蜕皮期的幼蜱。Fig. 5 Morphology of the larvae of Rh. sanguineus (40) A. hatchling larvae; B. blood-saturated larvae; C. molting larvae. |
2.4.4 若蜱 从图6可见, 幼蜱蜕皮为若蜱后, 躯体变长, 整体呈深黄色, 假头基明显且呈六角形, 眼明显。背部盾板清晰可见, 缘垛分明。若蜱足4对, 且颜色变为深黄, 透明度降低。足部有明显的5节, 且最前端具有爪垫。腹面观可见生殖孔以及肛侧板, 但尚未发育完全。饱血的若蜱呈深红色, 体型膨大; 在饱血后的第12天, 若蜱蜕皮发育为成蜱。
2.4.5 成蜱 成蜱体型更大, 为深褐色。假头基已完全发育成六角形, 眼明显。雄蜱背面盾板颜色较深且清晰, 呈卵圆形, 前端渐窄, 后端圆钝, 几乎覆盖整个背部。可观察到刻点, 但大小不一, 深浅分明, 分布不均。缘垛清晰可见。生殖孔发育成熟。足细长, 具5节, 足垫短小。雄蜱腹面可清晰看到肛侧板近三角形, 副肛侧板锥形。雌蜱体长比雄蜱短, 体宽更宽; 盾板刻点不均, 但刻点更多, 盾板只覆盖背部1/3左右, 其他特点与雄蜱基本一致。见图7。
与血常规正常值相比(表2), 寄生蜱的兔血常规白细胞(WBC)、淋巴细胞(LYM)、淋巴细胞百分比(LYM%)、平均红细胞血红蛋白含量(MCH)值明显增高, 红细胞(RBC)、红细胞压积(HCT)、平均血红蛋白浓度(MCHC)值降低, 显示有炎性感染、轻度脱水和贫血。健康兔血常规正常, 未见明显异常。
| 表2 寄生前后新西兰白兔血常规项目参数比对 Table 2 Comparison of parameters of New Zealand white rabbit blood routine items before and after parasitism |
当新西兰白兔(n=6)被饥饿的血红扇头蜱(n=20)寄生后, 体质量在前3次寄生后平稳增长, 第4次寄生后, 体质量有下降趋势, 而未寄生的J0组的体质量持续上升。J0组新西兰白兔的体温在观察期内一直维持在正常范围内, 没有明显的升高或降低。而寄生后的新西兰白兔J1组的体温总体降低。总体而言, 寄生后的新西兰白兔的体质量和体温都发生明显变化, 可见蜱虫寄生后对新西兰白兔的影响较大。见图8。
在以往的研究中, 血红扇头蜱的实验室人工饲养方法主要是寄生在小鼠或者兔子身上, 由于它们的耳部毛发稀疏细小, 所以早期主要是制作布口袋寄生在小鼠和白兔的耳部[10]; 但在兔耳上安装进食装置没有考虑到有效使用实验动物的问题, 因为蜱虫(特别是早期的幼虫或若虫)可能会爬行并深深附着到耳道深处, 观察蜱虫进食和饱血情况变得困难[11]。为了提高蜱虫的吸血率, 最近几年对活体动物饲养蜱虫也逐渐优化出许多实验装置[12], 但在研究过程中, 由于存在很多难以控制的变量, 使得这些新型的方法研究费用昂贵, 难以复制出完全相同的动物饲养模型。因此, 在研究蜱类生物学或寻找蜱虫防治的解决方法时, 建立一个有效的蜱类饲养系统至关重要。近年来, 已经开发了几种人工膜喂养系统, 例如使用体外喂养进行的RNA干扰、特定抗体作用的功能基因组分析以及在病原检测方面的研究[13], 体现出血液喂养行为的重要性。人工喂养包括提供模拟自然条件的线索, 如相似的温度、湿度和附着刺激, 开发一种具有模仿宿主皮肤特定硬度的不可生物降解的弹性膜, 以及提供足够的营养供应[14]。但蜱虫在吸血时表现出的一系列表现包括气味吸引和附着在宿主体表的行为, 这种特殊的相互作用暂时无法复制。
体外人工膜喂养系统和传统动物饲养各有优点和不足。人工膜饲养系统可以模拟出病原体在蜱体内的获取和传播方式, 并且使用人工膜系统在媒介生物能力方面的研究中获得了有效结果[15]。蜱-宿主-病原体之间的相互作用极其复杂, 所以人工膜喂养系统也不能完全替代科学研究所需的生理生化条件[16]。动物饲养蜱类的缺点是费用昂贵, 而且需要专门的实验设施, 但是在某些情况下, 不得不使用实验动物作为宿主来保证实验结果的准确性, 这是人工膜系统不能完全模拟的。本研究旨在使用改进的传统动物饲养方法构建出海南地区血红扇头蜱的完整生活史, 评估蜱虫寄生后对新西兰白兔的影响。为了研究新干预措施的研究效果, OLIVIERI等[17]使用人工膜饲养方法培养血红扇头蜱虫的成虫时期, 并确定了立克次氏体在血红扇头蜱虫中的传播速度。本研究从野外采集蜱虫进行形态学与分子生物学鉴定, 最后筛选血红扇头蜱进行实验室种群传代培养, 利用开发的活体喂食装置可以减少研究中对活体动物新西兰白兔的需求, 从而增强动物福利和降低费用。
血红扇头蜱在野外环境与实验室条件下的发育时间具有差异, 野外环境因素复杂, 要完成1个世代需选择最适宜的气候条件, 所以野生型蜱虫的生活史往往呈周期性, 蜱发育一个世代往往需要1年甚至数年的时间[18]。在发育时间上, 长角血蜱每年5月便开始感染宿主, 直到6月下旬达到巅峰, 寄生期长达2~3个月[19]。而本研究中, 人工饲养的血红扇头蜱发育1个完整的世代需要61~83 d就可以完成。海南地区的血红扇头蜱人工饲养温度整体保持在28 ℃左右, 但吴嘉彤等[20]在实验中发现, 在一定温度范围内, 随着温度的升高, 蜱的发育时间缩短, 当环境温度大于40 ℃时, 蜱会停止发育。关于湿度对于蜱发育的影响研究表明[21], 蜱虫在不同时期对湿度的适应能力不同, 海南地区长年气温变化小, 湿度保持在86%~90%, 适宜的湿度极大地缩短了血红扇头蜱的发育周期。但部分蜱虫对湿度要求严格, 如森林革蜱的卵在相对湿度65%以上时才能孵化为幼虫, 随着发育的不断进行, 若虫、成虫所需要的最低相对湿度不断降低。另一方面, 绝大多数的蜱虫会更加适应与环境相似的湿度, 如硬蜱属(Ixodes)的卵形硬蜱(Ixodes ovatus)和哈氏硬蜱(Ixodes hyatti), 需要的相对湿度为75%~96%[21]。除此之外, 蜱分泌的多种生物活性分子会调节宿主的免疫系统[19], 从而减轻宿主对蜱的免疫排斥反应。为了增强自身免疫能力, 宿主体内的多种细胞也会不断分泌相关分子来抵抗外源物质, 如巨噬细胞所产生的细胞因子与一氧化氮(NO)等都具有良好的抗炎作用[22]。但这种相互作用会影响寄生过程中的生理活性, 如果长时间在同一宿主身上寄生蜱虫, 宿主将产生免疫作用, 导致蜱在后续的发育中会产生吸血量减少、吸血时间延长及蜕皮受阻等现象[23]。所以, 为保证蜱最大程度的活性和最准确的发育周期, 在寄生蜱虫时需要更换宿主以减轻这种宿主免疫的影响[8]。
蜱虫的危害不仅是在吸血过程中分泌的多种生物活性物质带来的不良反应和口器在割破宿主皮肤时的机械性损伤, 同时, 蜱所携带的病毒、细菌和原虫也极大地威胁着人类健康和家畜养殖, 间接地影响着畜牧业的发展。因此, 研究出一套快速的、合理的蜱虫饲养方案促进其病理学的深入研究十分必要。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|