作者简介:许小珊(1991—),女,博士在读,研究方向:HIV分子流行病学。黄荣叶(1990—),男,本科,主管医师,研究方向:艾滋病综合防治。
#黄荣叶同为第一作者
目的 了解治疗前耐药(pretreatment drug resistance,PDR)对抗病毒治疗12个月病毒抑制影响情况,为艾滋病进一步扩大治疗并提高效果提供科学数据。方法 从我国艾滋病综合防治信息系统中选取广西钦州市2014年1月—2020年6月治疗前HIV感染者并收集现场和治疗数据,并对血样进行病毒RNA提取、pol基因区扩增和测序及耐药分析。采用Logistic回归模型分析治疗前耐药对抗病毒治疗12个月病毒抑制影响情况。结果 调查对象治疗前耐药率为5.5%(116/2 122, 95% CI: 4.5~6.4),NNRTIs类药物的耐药率最高 (3.1%,66/2 122)。抗病毒治疗12个月病毒抑制率为96.0%,其中治疗前不耐药组和耐药组分别为96.4%(1 213/1 259, 95% CI: 95.2~97.3)和89.7%(70/78, 95% CI: 80.8~95.5),两者之间差异有统计学意义 ( P=0.015)。在3个多因素Logistic回归模型分析中,与抗病毒治疗12个月病毒抑制有关的因素包括治疗前耐药 ( AOR=0.35, 95% CI: 0.15~0.82) (模型1);治疗前NNRTIs耐药 ( AOR=0.30, 95% CI: 0.10~0.88) 和NRTIs耐药 ( AOR=0.23, 95% CI: 0.06~0.90) (模型2);治疗前EFV/NVP中高度耐药 ( AOR=0.10, 95% CI: 0.03~0.35) (模型3)。结论 广西钦州HIV感染者治疗前耐药达WHO耐药中等水平,治疗前耐药显著降低了抗病毒治疗病毒抑制效果,尤其是治疗前EFV/NVP中高度耐药者。为有效遏制HIV耐药发生和传播,我国需要加强耐药监测及预防工作。
Objective To analyze the impact of pretreatment drug resistance (PDR) on virology after 12 months of antiviral therapy in newly reported HIV-infected individuals in Qinzhou, Guangxi, from 2014 to 2020, to provide a scientific basis for large-scale prevention and control efforts in China.Methods Newly reported HIV-infected individuals in Qinzhou City, Guangxi from Jan. 2014 to Jun. 2020 were selected from China's Comprehensive AIDS Prevention and Control Information System and collected epidemic and treatment follow-up information. Their confirmatory blood samples were subjected to viral RNA, pol gene reverse transcription amplification, sequencing and drug resistance analysis. Univariate and multivariate Logistic regression models were used to explore associations between pre-treatment resistance with viral inhibition after 12 months of ART.Results The overall PDR rate in the study population was 5.5% (116/2 122, 95% CI: 4.5-6.4), with the highest resistance rate for the NNRTIs class (3.1%, 66/2 122). The total inhibition rate of virus after 12 months of ART was 96.0%. Non-resistant and pre-treatment resistant were 96.4% (1 213/1 259, 95% CI: 95.2-97.3) and 89.7% (70/78, 95% CI: 80.8-95.5), respectively, and the difference was statistically significant ( P=0.015). In three multivariate Logistic regression model analysis, factors associated with viral suppression at 12 months of antiviral therapy included pre-treatment drug resistance ( AOR=0.35, 95% CI: 0.15-0.82) (Model 1); pre-treatment of NNRTIs resistant ( AOR=0.30, 95% CI: 0.10-0.88) and NRTIs resistant ( AOR=0.23, 95% CI: 0.06-0.90) (Model 2); and pre-treatment of EFV / NVP highly/moderate resistant ( AOR=0.10, 95% CI: 0.03-0.35) (Model 3).Conclusions The PDR of HIV infected in Qinzhou of Guangxi reached the medium level of WHO. PDR significantly reduces the effectiveness of antiretroviral therapy, especially for EFV/NVP resistant individuals with poor viral suppression. To effectively curb the occurrence and spread of HIV drug resistance, China needs to strengthen PDR surveillance and prevention in the population before starting ART.
在过去十年中, 抗病毒疗法(antiretroviral therapy, ART)以前所未有的规模扩大, 截至2020年底, 全球有2 750万人接受ART[1]。然而, 随之带来的HIV耐药性可能进一步增加[2]。据2021年WHO发布的全球HIV耐药监测报告[1], 2014— 2021年中低收入国家或地区治疗前耐药水平明显上升, 且在35个国家中有21个国家NVP/EFV耐药超过中等水平(10%)。我国2009年前治疗前耐药处于低水平(< 5%)[3, 4], 但近几年调查结果显示我国多个地区治疗前耐药已达中等水平[5, 6, 7]。相关研究发现治疗前耐药影响抗病毒治疗病毒学效果, 欧洲一项研究显示治疗前耐药者在治疗12个月病毒抑制失败的风险高2~3倍[8], 以及来自多个国家或地区的PEARLS(ACTG A5175)临床试验结果显示治疗前耐药与病毒学失败时间缩短显著相关(HR:2.03; P=0.035)[9]。治疗前耐药严重阻碍了艾滋病防治目标的实现, 而我国在这方面的研究报道很少。广西壮族自治区(简称广西)是我国艾滋病疫情最严重的地区之一, 钦州是广西艾滋病重点地区[7, 10]。本研究选择在广西钦州开展治疗前耐药对抗病毒治疗12个月病毒抑制影响情况调查研究, 为艾滋病进一步扩大治疗并提高效果提供科学数据。
纳入标准:(1)年龄≥ 18周岁; (2)社会人口学资料完整, 抗病毒治疗基线信息和随访信息匹配; (3)HIV感染者抗病毒治疗开始时间为2014年1月1日— 2019年12月31日; (4)随访截止日期为2020年6月30日。本研究项目已通过广西疾控中心伦理审查委员会批准。研究对象均知情同意。
1.2.1 调查方法 采用队列研究的方法, 调查对象数据来自国家艾滋病综合防治信息系统。调查变量包括:年龄、性别、民族、文化程度、婚姻状况、感染途径、治疗前CD4+T淋巴细胞计数、治疗前WHO临床分期、初始抗病毒治疗方案、目前治疗方案及病毒抑制情况。根据WHO推荐的HIV耐药性监测指南[11]将病毒抑制定义为HIV RNA病毒载量< 1 000拷贝/mL。
1.2.2 实验室检测 从HIV感染者血浆中提取RNA, 参考《全国艾滋病检测技术规范(2020年修订版)》对Pol区(HXB2:2253-3869)进行扩增得到目的基因片段, 琼脂糖凝胶电泳并进行Sanger 基因测序。
1.2.3 耐药判定 将序列提交至斯坦福耐药数据库(Stanford HIV Drug Resistance Database, http://hivdb.Stanford.edu), 通过在线分析工具对耐药突变位点(drug resistance mutations, DRMs)鉴定和解释, 得到所有抗病毒治疗药物的耐药程度以及耐药突变位点情况。根据耐药评分将药物敏感性分为五个水平:敏感(0~9)、潜在耐药(10~14)、低度耐药(15~29)、中度耐药(30~59)和高度耐药(≥ 60)。本研究定义所有抗病毒治疗药物中有一种及以上药物耐药评分≥ 15判断为耐药。
1.2.4 分子传播网络构建 用HIV-TRACE推断HIV的分子传播网络, 在所有序列之间建立假定的传播联系。使用bealign命令将HIV pol序列与HXB2参考序列(位置:2253-3869)比对齐, 并根据Tamura-Nei 93(TN93)模型计算成对的基因距离[12]。通过建立不同基因距离(范围为0.1%~1.5%)的分子网络, 选择成簇数最多的基因距离作为分析阈值。以基因距离阈值构建分子网络并赋予分子网络中所有研究对象流行病学信息。
采用SAS V9.4(SAS Institute Inc., Cary, NC, USA)软件进行数据整理及分析。分类变量以例数和百分比表示, 使用Pearson's卡方检验或Fisher's精确检验进行比较, Bonferroni法进一步多重比较。治疗前耐药对抗病毒治疗12个月病毒抑制影响统计分析采用多因素二项Logistic回归模型。检验水准为α =0.05。
广西钦州2014— 2019年初始抗病毒治疗HIV感染者2 122例。调查对象以50岁及以上(占52.5%)、男性(占70.4%)和汉族(占91.0%)为主; 小学及以下占51.6%, 初中及以上占48.4%; 已婚或同居占63.8%; 感染途径主要为异性传播(占95.1%); 治疗前WHO临床分期主要为Ⅰ /Ⅱ (占60.7%), CD4+T淋巴细胞计数< 350 cells/mm³ 占79.4%。构建系统进化树结果显示, 以CRF01_AE为主(占57.9%)。初始抗病毒治疗方案主要为TDF +3TC+ EFV/NVP(占56.1%)和AZT +3TC+ EFV/NVP(占35.7%)。见表1。
| 表1 HIV感染者基本情况 Table 1 Characteristics of HIV-infected individuals |
2.2.1 不同抗病毒药物耐药情况 2 122例HIV感染者耐药率为5.5%(116/2 122, 95%CI:4.5~6.4), 其中, NNRTIs、NRTIs、PIs三类药物的耐药率分别为3.1%(66/2 122)、1.5%(32/2 122)和1.0%(21/2 122), 三者差异有统计学意义(χ 2=28.27, P< 0.001)。经两两比较后, NNRTIs类药物的耐药率均高于NRTIs类药物(χ 2=12.07, P< 0.001)和PIs类药物(χ 2=23.76, P< 0.001), NRTIs类药物和PIs类药物的耐药率差异无统计学意义(χ 2=2.31, P=0.128)。见表2。
| 表2 HIV感染者治疗前耐药突变情况 Table 2 Drug-resistant mutations in pretreatment drug resistance HIV populations |
2.2.2 耐药程度分级情况 NNRTIs类药物中, EFV/NVP中高度耐药率为2.2%(47/2 122); NRTIs类药物中, D4T总耐药率最高(1.0%, 22/2 122), 其次是DDI(0.9%, 19/2 122), ABC(0.6, 13/2 122), AZT(0.6%, 13/2 122)和TDF(0.3%, 7/2 122); PIs类药物中LPV/r无中高度耐药。见表2。
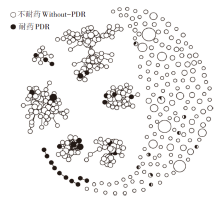
2.2.3 调查对象分子传播网络特征 以基因距离阈值0.5%构建分子网络, 有799人进入网络, 入网率为37.7%(799/2 122)。治疗前耐药者分布在20个分子簇中, 在11个分子簇中含有2人及以上治疗前耐药者。见图1。
HIV感染者抗病毒治疗12个月病毒载量检测人数有1 337人, 总病毒抑制率为96.0%(1 283/1 337, 95% CI:94.8~97.0)。治疗前不耐药组和耐药组抗病毒治疗12个月病毒抑制率分别为96.4%(1 213/1 259, 95% CI:95.2~97.3)和89.7%(70/78, 95% CI:80.8~95.5), 两者之间差异具有统计学意义(P=0.006)。采用多因素Logistic回归模型统计分析, 调整人口学和临床特征变量:年龄、性别、民族、文化程度、婚姻状况、感染途径、HIV-1亚型、治疗前CD4+T淋巴细胞计数、治疗前WHO临床分期、初始抗病毒治疗方案、目前治疗方案。统计分析结果显示:与抗病毒治疗12个月病毒抑制有关的因素包括治疗前耐药(AOR=0.35, 95%CI: 0.15~0.82), 见表3(模型1); 治疗前NNRTIs耐药(AOR=0.30, 95%CI: 0.10~0.88)和NRTIs耐药(AOR=0.23, 95%CI: 0.06~0.90), 见表3(模型2); 治疗前EFV/NVP中高度耐药(AOR=0.10, 95%CI: 0.03~0.35), 见表3(模型3)。
| 表3 治疗前耐药对HIV感染者抗病毒治疗12个月病毒抑制影响的统计分析结果 Table 3 Analysis of effect of PDR on viral inhibition in HIV infected patients after 12 months of antiviral treatment |
本研究广西钦州2014— 2020年HIV感染者治疗前耐药率为5.5%(194/3 236, 95% CI:4.5%~6.4%)。根据WHO对HIV耐药性低、中和高水平的定义(< 5%, 5%~15%和> 15%), 该地区耐药达中等流行水平。在2012— 2013年该地区治疗前耐药率为2.6%(1/38, 95%CI:2.5%~7.7%)[13]。2014至2020年广西钦州市治疗前耐药总体患病率无下降趋势[14]。除了广西, 在我国艾滋病疫情严重的其他省份, 治疗前耐药也呈上升趋势[15]。值得注意的是, 治疗前耐药主要是受NNRTI耐药影响, 尤其在大多数治疗前耐药率超过10%的中低收入国家或地区[1], NNRTI耐药也达中等流行水平。另外, 通过分子传播网络分析发现, 出现部分2名及以上治疗前耐药者在同一个分子簇中, 这在一定程度上提示该地区存在耐药毒株传播的风险。
本次调查HIV感染者抗病毒治疗12个月病毒抑制率为96.0%。根据WHO指南推荐的抗病毒治疗病毒抑制标准(病毒载量< 1 000拷贝/ mL), 分为良好:病毒抑制率≥ 90%; 一般:病毒抑制率80%~ 90%; 较差:病毒抑制率< 80%[11], 本研究病毒抑制达到良好水平, 而大多数中低收入国家或地区病毒抑制未能达到良好水平[1]。同时, 2021年联合国艾滋病规划署提出的“ 2030年全球消除艾滋病” 的防治目标要求, 抗病毒治疗病毒抑制率要达95%, 该地区病毒抑制率已达到该要求。
本研究治疗前耐药患者的抗病毒治疗病毒抑制率(89.7%)处于一般水平, 且与“ 2030年全球消除艾滋病” 的防治目标要求仍有一定距离。欧洲一项关于治疗前耐药组抗病毒治疗病毒抑制失败的比值比为3.13(95%CI: 2.33~4.20)[8]。另一项[16]在撒哈拉以南非洲地区的研究也显示其比值比为2.13(95%CI: 1.44~3.14)。我们进一步分析HIV感染者治疗前三大类药物耐药性对抗病毒治疗病毒抑制的影响, 发现治疗前对NNRTIs类或NRTIs类药物耐药的HIV感染者更容易出现病毒抑制失败, 这与国际上研究结果一致[16, 17]。目前, 大部分中低收入国家或地区以NNRTI类(EFV/NVP)为基础的一线治疗方案。通过进一步分析, 发现抗病毒治疗病毒抑制失败与EFV/NVP中高度耐药有关。肯尼亚队列研究结果报道[18], 治疗前NVP耐药和不耐药的病毒抑制失败率(69.2%和10.4%)两者之间差异有统计学意义, 且治疗前EFV耐药和不耐药的病毒抑制失败率(25.0%和5.0%)差异也有统计学意义。
本研究有一定局限性。我们应用的Sanger测序方法只能在HIV阳性个体中检测到15%~20%比例的耐药毒株, 可能低估了治疗前耐药率, 我们将采用下一代测序来识别低频耐药毒株。另外, 本研究耐药位点通过基因型耐药检测判定, 缺乏表型测试来提供体外证据。即使RPV不在我国一线和二线治疗方案中也依然耐药率较高, 一项研究报道基因型耐药检测结果会高估ETR和RPV的耐药性[19]。所以, 在未来我们需要表型耐药检测的方法来补充基因型耐药结果。
总之, 本研究通过较大样本量调查了解我国广西治疗前耐药对HIV感染者抗病毒治疗12个月病毒抑制影响情况。研究结果充分说明我国需加强HIV耐药监测和预防工作, 有效遏制HIV耐药毒株的发生和传播。
利益冲突声明 所有作者声明不存在利益冲突
编辑:谢永慧
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|