作者简介:李庆贺(1983—),男,硕士,主治医师,研究方向:肝包虫病的手术治疗、寄生虫感染与免疫。
目的 采用生物信息学软件分析棘球绦虫主要虫卵抗原(MEAs)蛋白的分子特性。方法 从NCBI蛋白质数据库中下载棘球绦虫MEAs蛋白的氨基酸序列,采用ProtParam、NetSolP-1.0、SignalP-5.0、TMHMM 2.0、ProtComp 9.0、Structure、NetPhos 3.1、BCPREDS等在线分析程序预测理化性质、在大肠杆菌中的表达特性、信号肽、跨膜结构域、亚细胞定位、保守结构域、磷酸化位点及B细胞表位,并通过MEGA 6.06程序对不同物种来源的MEAs蛋白构建进化树。结果 对11条棘球绦虫MEAs蛋白序列进行分析,序列长度为314~503 aa,等电点为5.73~7.26,分子量为35 843.76~ 54 356.24;在大肠杆菌中表达的可溶性为0.488 0~0.563 2,可用性为0.254 5~0.283 5;均具有典型的α晶体结构域,属于HSP20超家族;均含有丝氨酸磷酸化位点、苏氨酸磷酸化位点和酪氨酸磷酸化位点;均不存在信号肽序列及跨膜结构域,为非分泌、非跨膜蛋白;主要定位于胞质、胞核,在线粒体、胞外和质膜上也有分布;棘球绦虫MEAs蛋白优势B细胞抗原表位的数量为1~3。不同物种来源的MEAs蛋白分为两大枝,其中EmMEAp40_1、EgMEA_4、EgMEAp40_1 与微小膜壳绦虫MEAp40等聚为一枝,其余8条棘球绦虫MEAs蛋白与日本血吸虫MEAs等聚为一枝。结论 通过生物信息学软件筛选了棘球绦虫MEAs蛋白的优势B细胞抗原表位,为进一步研究棘球绦虫MEAs蛋白的生物学功能提供参考。
Objective To analyze the molecular characteristics of major egg antigens (MEAs) from Echinococcus granulosus and Echinococcus multilocularis with bioinformatic software.Methods The amino acid sequences of MEAs from Echinococcus granulosus and Echinococcus multilocularis were downloaded from the protein database on NCBI. Bioinformatic tools, such as ProtParam, NetSolP-1.0, SignalP-5.0, TMHMM 2.0, ProtComp 9.0, Structure, NetPhos 3.1, BCPREDS, were used to analyze the physicochemical characteristics, expression properties in E. coli, signal peptide, transmembrane domain, subcellular localization, conserved structural domains, phosphorylation sites, and B cell epitopes of MEAs from Echinococcus granulosus and Echinococcus multilocularis. Phylogenetic tree construction of MEAs from various species was performed using MEGA 6.06.Results 11 MEAs were coded by 314-503 aa, with the isoelectric point of 5.73-7.26, the molecular weight of 35 843.76-54 356.24. The solubility and availability of expression in E.coliwas 0.488 0-0.563 2, and 0.254 5-0.283 5 respectively. Typical α-crystal domains were found in all 11 MEAs, indicating that MEAs from Echinococcus granulosus and Echinococcus multilocularis belongs to the HSP20 superfamily. Serine phosphorylation sites, threonine phosphorylation sites and tyrosine phosphorylation sites were found in all 11 MEAs. Signal peptide sequence and transmembrane domains were not be found in all 11 MEAs, indicating that MEAs from Echinococcus granulosus and Echinococcus multilocularis belonged to non-secretory and non-transmembrane proteins. 11 MEAs mainly located in cytoplasm and nucleus, and also distributed in mitochondria, extracellular and plasma membrane. The number of dominant B cell epitopes of MEAs from Echinococcus granulosus and Echinococcus multilocularis was 1-3. MEAs proteins from different species were divided into two branches, among which EmMEAp40_1, EgMEA_4, EgMEAp40_1 and H ymenolepis microstoma MEAp40 were clustered into one branch, and the other eight MEAs proteins were clustered into one branch with Schistosoma japonicum MEAs.Conclusion Bioinformatics software is used to screen the dominant B cell epitopes of MEAs proteins from Echinococcus granulosus and Echinococcus multilocularis, which provide references for the further study of biological functions of MEAs proteins from Echinococcus granulosus and Echinococcus multilocularis.
棘球绦虫中绦期幼虫感染引起的棘球蚴病, 又称为包虫病, 是一种人兽共患寄生虫病。目前被公认的能够感染人体的棘球绦虫有4种, 以细粒棘球绦虫 (Echinococcus granulosus, Eg)和多房棘球绦虫 (Echinococcus multilocularis, Em)感染最为常见, 分别引起囊型包虫病 (cystic echinococcosis, CE)和泡型包虫病 (alveolar echinococcosis, AE) [1]。我国是包虫病高发的国家之一, 受威胁人口数和患者数居全球首位, 主要流行于西藏、青海、四川等省(自治区)的牧区或半农半牧区, 严重影响人体健康和畜牧业发展[2, 3]。目前包虫病的研究主要集中在诊断方法、疫苗研发、靶向药物等方面[4, 5]。
虫卵是包虫病在人畜间的感染源。由于虫卵没有角质层的保护, 进入宿主体内后仅极少数能发育为病灶[6]。虫卵的数量和活性决定感染中间宿主的成败, 因此, 筛选鉴定理想的虫卵抗原, 确定包虫病免疫诊断候选抗原、抗包虫病疫苗候选分子或药物靶标分子是我们探索防控包虫病的新途径。
主要虫卵抗原 (major egg antigen, MEA) 具有α 晶体结构域, 属于小热休克蛋白HSP20多基因家族。研究表明, MEAp40可作为潜在的免疫诊断抗原[7, 8], MEA可作为包虫病的诊断标志物[9], EmMEA[10]和EmMEAp40_1[11]多克隆抗体可识别天然EmMEA蛋白和EmMEAp40_1蛋白, 具有作为AE的诊断抗原的潜能。
本研究通过生物信息学分析了11条棘球绦虫MEAs蛋白序列, 筛选了其优势B细胞抗原表位, 为进一步研究棘球绦虫MEAs蛋白的生物学功能提供参考。
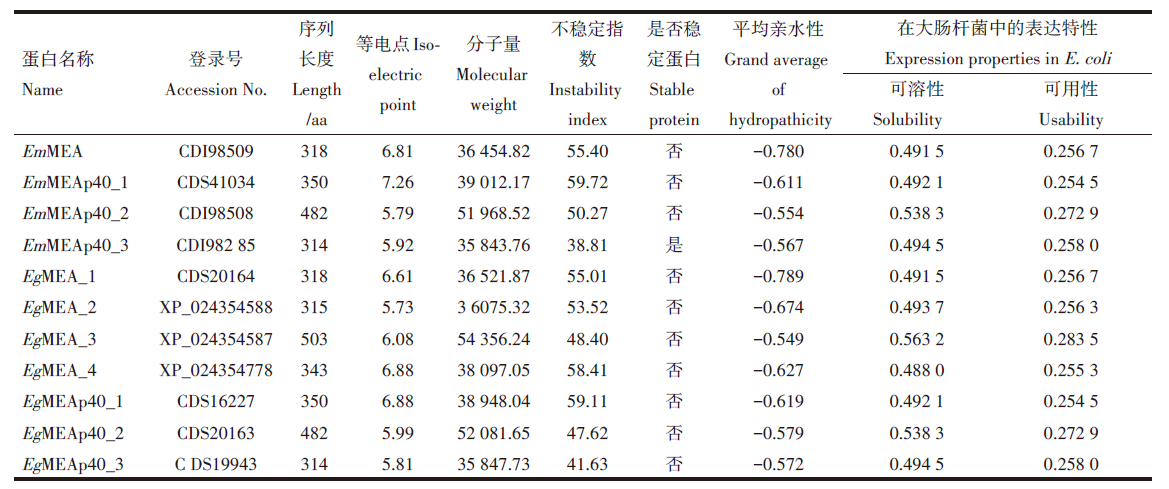
从NCBI的蛋白质数据库 (http://www.ncbi.nlm.nih.gov/protein/) 中共检索11条棘球绦虫MEAs蛋白序列, 其中EmMEAs 4条、EgMEAs 7条, 登录号及在文中的命名见表1。
| 表1 棘球绦虫MEAs蛋白的理化性质及在大肠杆菌中的表达特性 Table 1 Physicochemical characteristics and expression properties in E. coli of MEAs proteins from Echinococcus |
采用ProtParam程序 (http://web.expasy.org/protparam/) 分析棘球绦虫MEAs蛋白的序列长度、分子质量、不稳定指数等理化性质, 并通过NetSolP-1.0程序(https://services.healthtech.dtu.dk/service.php?NetSolP-1.0) 预测其在大肠杆菌中表达的可溶性和可用性。分别采用SignalP-5.0程序(http://www.cbs.dtu.dk/services/SignalP-5.0/)、TMHMM 2.0程序(http://www.cbs.dtu.dk/services/TMHMM2.0/)和ProtComp 9.0 程序(http://www.softberry.com/berry.phtml?topic=protcompan& group=programs& subgroup=proloc)预测棘球绦虫MEAs蛋白的信号肽序列、跨膜结构域及亚细胞定位。采用 SMART 程序(http://smart.embl-heidelberg.de/smart/)和Structure程序(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi) 分析棘球绦虫MEAs蛋白序列中的保守结构域。采用NetPhos 3.1 程序 (http://www.cbs.dtu.dk/services/NetPhos3.1/) 预测棘球绦虫MEAs蛋白序列中的磷酸化位点。采用IEDB网站上的Bepipred Linear Epitope Prediction 2.0程序(http://tools.iedb.org/bcell/) 预测棘球绦虫MEAs蛋白的B细胞表位, 并结合BCPREDS程序(http://ailab-projects1.ist.psu.edu:8080/bcpred/predict.html)中BCPred和AAP子程序的预测结果, 筛选棘球绦虫MEAs蛋白优势B细胞抗原表位。采用Blastp程序 (http://blast.ncbi.nlm.nih.gov/) 对11条棘球绦虫MEAs序列进行两两比对, 并通过MEGA 6.06程序(http://www.megasoftware.net/)对不同物种来源的MEAs蛋白构建进化树。
棘球绦虫MEAs蛋白序列长度为314~503 aa, 等电点为5.73~7.26, 分子量为35 843.76~54 356.24, 平均亲水性为 -0.789~-0.549。11条棘球绦虫MEAs蛋白中, 除了EmMEAp40_3的不稳定指数< 40, 为稳定蛋白, 其余均为不稳定蛋白。棘球绦虫MEAs蛋白在大肠杆菌中表达的可溶性为0.488 0~0.563 2, 可用性为0.254 5~0.283 5, 见表1。
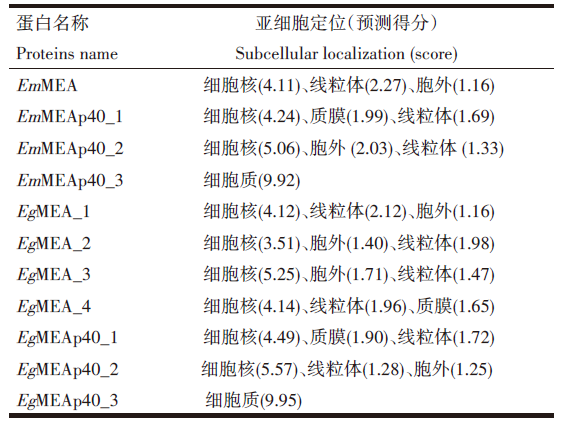
11条棘球绦虫MEAs蛋白均不存在信号肽序列及跨膜结构域, 为非分泌、非跨膜蛋白。11条棘球绦虫MEAs蛋白中, EmMEAp40_3和EgMEAp40_3仅定位于胞质, 其余9条MEAs蛋白主要定位于胞核, 在线粒体、胞外和质膜上也有分布, 见表2。
| 表2 棘球绦虫MEAs蛋白的亚细胞定位 Table 2 Subcellular localization of MEAs proteins from Echinococcus |
11条棘球绦虫MEAs蛋白均具有典型的α 晶体结构域, 属于HSP20超家族。
棘球绦虫MEAs蛋白均含有丝氨酸磷酸化位点(13~60个)、苏氨酸磷酸化位点(5~24个)和酪氨酸磷酸化位点(3~4个)。11条棘球绦虫MEAs蛋白中, EmMEAp40_2、EgMEA_3和EgME Ap40_2的磷酸化位点超过80个; EmMEAp40_1、EgMEA_4 和EgMEAp40_1的磷酸化位点为60余个; 其余5种棘球绦虫MEAs蛋白的磷酸化位点相对较少, 为28~32个。
通过Bepipred Linear Epitope Prediction 2.0程序和BCPREDS程序的BCPred和AAP算法预测棘球绦虫MEAs蛋白的B细胞表位, 筛选出棘球绦虫MEAs蛋白优势B细胞抗原表位, 见表3。
| 表3 棘球绦虫MEAs 蛋白的B细胞表位 Table 3 B cell epitopes of MEAs proteins from Echinococcus spp. |
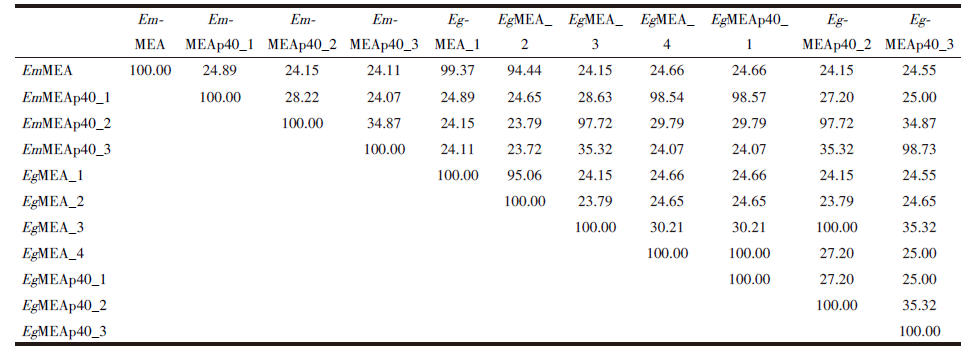
11条棘球绦虫MEAs蛋白序列一致性为23.72%~100%(表4), 其中, EgMEA_3和EgMEAp40_2、EgMEA _4和EgMEAp40_1的序列一致性为100%。分析发现, EgMEA_3 蛋白序列N末端比EgMEAp40_2多21 aa(图1A), EgMEAp40_1蛋白序列N末端比EgMEA_4多7 aa(图1B)。
| 表4 棘球绦虫MEAs蛋白序列两两比对 Table 4 Pairwise sequence alignment of MEAs proteins from Echinococcus |
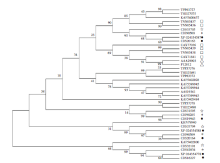
通过对不同物种来源的MEAs构建最大似然树, 不同物种来源的MEAs蛋白分为两大枝。11条棘球绦虫MEAs蛋白中, EmMEAp40_1、EgMEA_4、EgMEAp40_1 与微小膜壳绦虫MEAp40 (登录号CDS32 101) 、异端并殖吸虫MEA (登录号KAF5402800) 聚为一枝, 其余8条棘球绦虫MEAs蛋白与微小膜壳绦虫MEA (登录号CDS33704)、MEA (登录号CDS33 705)、MEAp40(登录号CDS31595) 以及日本血吸虫MEAs、曼氏血吸虫MEAs聚为一枝, 见图2。
随着棘球绦虫基因组测序工作的完成, 国内外研究者通过基因组学、蛋白质组学、生物信息学和分子生物学方法阐明了多种棘球绦虫蛋白的功能[12, 13, 14, 15]。与传统的实验方法相比, 通过生物信息学预测蛋白的结构、功能具有高效、省时、花费低的优点。目前, 关于棘球绦虫MEAs的研究较少, 对棘球绦虫MEAs蛋白的分子特性进行生物信息学分析, 不仅为研究棘球绦虫MEAs的生物学功能奠定基础, 亦可为抗包虫病疫苗的研发、靶向药物的筛选提供参考。
本研究表明棘球绦虫以大肠杆菌为宿主菌进行蛋白表达, 所获得的棘球绦虫MEAs重组蛋白为可溶性蛋白, 存在于上清中, 有利于蛋白的纯化。11条棘球绦虫MEAs蛋白序列均不存在信号肽序列及跨膜结构域, 为非分泌、非跨膜蛋白, 均具有典型的小热休克蛋白所共有的α 晶体结构域, 属于HSP20蛋白超家族。
免疫荧光组织定位结果显示, EmMEAp40_3主要分布于原头蚴后端, 在头节、体壁及囊壁中均不表达[11], 与本研究预测的定位于胞质中一致。免疫荧光组织定位结果显示, EmMEA仅分布于原头蚴的体壁, 细胞核上有较强的荧光信号[10], 与本研究预测的主要定位于胞核, 在线粒体、胞外也有分布一致。
磷酸化在细胞周期、信号转导、生长发育等生物学过程中发挥重要作用[16]。真核生物的磷酸化位点主要发生在丝氨酸、苏氨酸和酪氨酸, 而原核生物的磷酸化位点主要发生在组氨酸、精氨酸和赖氨酸。11条棘球绦虫MEAs蛋白序列均具有多个磷酸化位点, 提示这些蛋白可能通过磷酸化参与了棘球绦虫细胞周期、信号转导、生长发育等生物学过程。
以往研究者要制备某蛋白相应的抗体, 需通过克隆、分离和纯化完整的蛋白抗原, 过程复杂、费时费力; 而通过生物信息学预测某蛋白的抗原表位, 筛选优势抗原表位后合成肽段, 制备相应抗体可达到事半功倍的效果[17, 18]。抗原表位, 又称为抗原决定簇, 是指抗原分子中决定抗原特异性的特殊化学基团, 常由9~15 aa组成, 包括T细胞表位和B细胞表位。由于T细胞表位的预测方法少且准确性不高, 通过预测某蛋白的B细胞表位, 从而筛选优势B细胞抗原表位, 用于进一步的研究[19, 20]。本研究筛选出了11条棘球绦虫MEAs蛋白序列的优势B细胞抗原表位, 为合成多肽制备棘球绦虫MEAs抗体提供参考。序列比对结果表明, EgMEA _3蛋白序列N末端比EgMEAp40_2多21 aa, EgMEAp40_1蛋白序列N末端比EgMEA_4多7 aa, 但序列一致性为100%, 多出来的氨基酸是否影响蛋白的功能, 还需进行进一步的研究证实。
本研究构建的最大似然树中, 不同物种来源的MEAs蛋白分为两大枝。11条棘球绦虫MEAs蛋白序列中, 8条棘球绦虫MEAs蛋白与日本血吸虫MEAs、曼氏血吸虫MEAs等聚为一枝, 可能发挥与日本血吸虫MEAs、曼氏血吸虫MEAs相同的生物学功能, 可作为潜在的免疫诊断抗原; 而EmMEAp40_1、EgMEA_4、EgMEAp40_1与微小膜壳绦虫MEAp40 、异端并殖吸虫MEA聚为另一枝, 可能为棘球绦虫进化过程中新形成的蛋白。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|