作者简介:邵雷(1989—),男,硕士,主管技师,研究方向: 输血相关传染病病原体检测与分子生物学研究。
目的 建立一种重组酶介导等温扩增技术(RAA)检测疟原虫的方法。方法 针对疟原虫属保守18S小亚基核糖体RNA (18S rRNA)基因设计特异性引物,筛选确定最佳引物对组合并建立疟原虫重组酶介导核酸等温扩增体系。通过该RAA体系检测疟原虫标准质粒、4种疟原虫[恶性疟原虫( Plasmodium falciparum, P.f )、间日疟原虫( P. vivax, P.v)、三日疟原虫( P. malaria, P.m)、卵形疟原虫( P. ovale, Po)]病原体以及其他6种输血传播寄生虫(婴儿利士曼原虫、杜氏利士曼原虫、刚地弓形虫、溶组织阿米巴虫、犬吉氏巴贝西虫、田鼠巴贝虫),以评估该体系的灵敏度和特异度。结果 筛选出一组扩增效果较好的引物对,整个RAA体系使用最佳引物对在37 ℃,20 min即可完成扩增,对标准质粒的检测下限为10-2 copies/μL,恶性疟原虫、间日疟原虫和卵形疟原虫为102copies/μL,三日疟原虫为10 copies/μL。RAA检测体系未与其他输血传播寄生虫产生交叉反应,特异性良好。应用RAA方法检测外籍学生献血者标本,结果与荧光定量PCR结果一致。结论 成功建立了一种快速、简便和特异的疟原虫RAA检测方法,将会给血液筛查和一些基层偏远医院的临床检测提供很大帮助。
Objective To establish a recombinase-aided amplification (RAA) assay method for detection of Plasmodium species.Methods Plasmodium-specific primers are designed for the conserved 18S small subunit ribosomal RNA (18S rRNA) gene. Plasmodium standard plasmids, DNA of four Plasmodium pathogens, Plasmodium falciparum ( P.f ), P. vivax ( P.v), P. malaria ( P.m), P. ovale ( P.o) and six other transfusion-transmitted parasites ( Leishmania infantile,Leishmania durandii, Toxoplasma gondii, Amoeba histolytica, Babesia guisi,and Babesia microti) were used to assess the sensitivity and specificity of the RAA system.Results A set of primer pairs with good amplification effect were selected. The whole RAA system could be amplified at 37 ℃ for 20 minutes using the optimal primer pair. The detection limit of standard plasmids was 10-2copies/μL, Pf, Pv and Po was 102 copies/μL, and Pm was 10 copies/μL. The RAA system did not cross-react with other transfusion-transmitted parasites and showed good specificity. The samples from foreign blood donors were tested by RAA, and the results were all negative.Conclusions A simple and rapid RAA detection method with good sensitivity and specificity has been established, which will provide great help for blood donor screening and clinical detection in some remote areas.
疟疾是一种由雌性按蚊叮咬传播的虫媒传染病, 严重威胁世界各地人民的健康和安全。据报道, 五种能够感染人类并导致疟疾的疟原虫包括恶性疟原虫 ( Plasmodium falciparum, P.f )、间日疟原虫(P. vivax, P.v)、三日疟原虫(P. malaria, P.m)、卵形疟原虫( P. ovale, Po)和诺氏疟原虫( P. knowlesi)。其中撒哈拉以南非洲承担了全球近80%的疟疾负担, 而恶性疟原虫是主要的致病因素[1]。根据世界卫生组织WHO发布的《2021年世界疟疾报告》, 2020年, 虽然各国通过积极行动, 避免了世卫组织预测的最坏情况— — 撒哈拉以南非洲的疟疾死亡人数增加1倍, 但与2019年相比, 2020年感染疟疾的人数仍增加了1 400万, 死亡人数增加了6.9万。新增死亡人数中约2/3与新冠肺炎大流行期间疟疾服务中断有关[2]。我国曾经经历过疟疾大流行, 但经各方努力, 已经连续4年没有本土病例报道, WHO于2021年6月30日正式认证中国为无疟疾国家[3]。但是随着近年来国际交流的增多, 越来越多的人往来于疟疾流行的国家, 导致输入性疟疾发病率呈上升趋势。无症状疟疾感染者对我国全面消灭疟疾以及血液安全都构成了巨大挑战[4]。疟疾感染的筛查传统上以显微镜检查为金标准。但镜检诊断疟原虫对技术人员专业要求高, 而且随着血液原虫密度低的患者所占比例增大, 传统的血膜涂片染色镜检法费时、费力且容易漏检[5]。疟疾的分子诊断有多种模式, PCR是目前广泛采用的实验室疟疾诊断方法, 但对仪器设备耗材的要求以及扩增时间较长限制了其用于常规筛查。近几年发展起来的等温扩增法, 包括环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)、重组酶聚合酶扩增技术(recombinase polymerase amplification, RPA)、重组酶介导等温扩增技术(recombinase-aided amplification, RAA)等[5], 降低了对仪器设备和操作人员的要求, 成为研发热点。
RAA是一种新型等温核酸扩增技术, 凭借简便、快速、灵敏度高等优势, 已被成功应用于多种寄生虫及其他病原体核酸检测中[6, 7]。本研究根据实验室现有条件和实验需求, 针对疟原虫属保守18S小亚基核糖体RNA(18S rRNA)基因设计疟原虫属特异性引物, 运用RAA技术检测疟原虫标准质粒和4种疟原虫病原体, 以建立一种稳定高效灵敏的疟原虫RAA分子检测技术, 并对其特异度和灵敏度进行评估。
4种疟原虫阳性标本DNA由江苏省寄生虫研究所提供; 包含18S rRNA 靶序列重组质粒质粒由南京钟鼎生物技术公司合成; 田鼠巴贝西虫成虫DNA来自中国疾病预防控制中心寄生虫防治所, 其他输血传播寄生虫来自江苏省奇天基因生物有限公司; 健康人全血标本来自江苏省血液中心合格献血者。
引物由上海生工生物有限公司合成。全血基因组DNA提取试剂盒购自美国Axygen公司, 50× TAE缓冲液购自北京索莱宝科技有限公司, Agarose 琼脂糖粉购自MBI公司, RAA试剂盒购自江苏奇天基因生物科技有限公司; 主要仪器:恒温水浴箱(上海福玛)、电泳仪(北京六一)、1 000 bp DNA Ladder(大连宝生物, 3591Q)、全自动数码凝胶分析系统Tannon2500(上海天能)。
1.3.1 全血基因组DNA提取 本实验中所用相关基因组DNA均根据Axygen DNA提取试剂盒说明书提取, Nanodrop DNA定量仪测定浓度和纯度, 纯度(A260/280)为1.70~1.80。
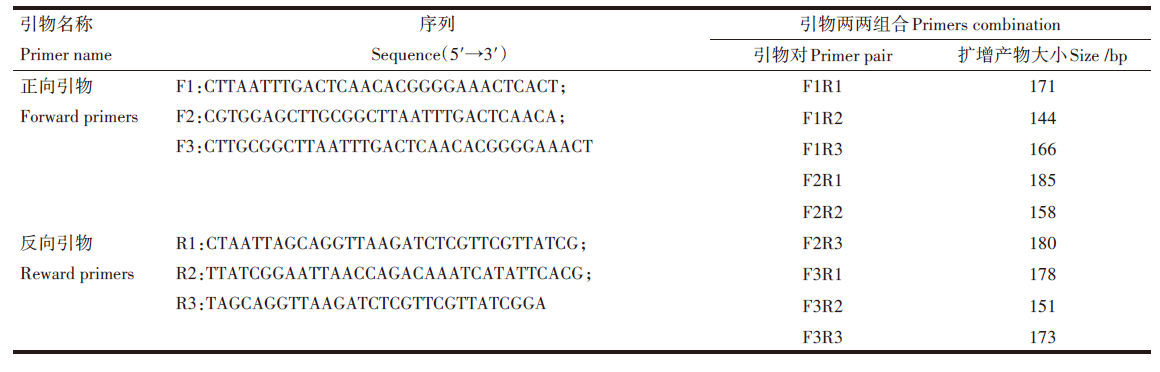
1.3.2 质粒构建和引物设计 根据疟原虫18S rRNA的基因序列, 同时比较GeneBank数据库中人类 18S rRNA以及4种疟原虫( P.f、P.v、P.m、P.o)18S rRNA 基因序列, 运用DNAMAN7.0软件进行同源性分析, 选择疟原虫属特异性基因序列(基因登录号M54897.1)中一段431 bp的保守区域作为RAA检测的靶标, 应用pMD18-T载体构建标准质粒。根据RAA原理, 设计属特异性通用上下游引物, 通过RAA反应筛选, 确定最佳引物组合。引物序列及扩增产物长度见表1。
| 表1 RAA引物设计 Table 1 RAA primers designed |
1.3.3 RAA扩增 使用基础RAA试剂盒对标准质粒和疟原虫阳性标本进行RAA扩增, 根据操作说明书, 在RAA基础反应单元中配制50 μ L反应体系, 包括2× 缓冲液 25 μ L, 引物F、R各1.5 μ L(终浓度为 200 nmol/L), 乙酸镁2.5 μ L , 基因组DNA或质粒 2 μ L, 补ddH2O至50 μ L。将配制好的基础反应单元置于37 ℃水浴锅中进行扩增, 20 min后取出, 产物用2%的琼脂糖进行电泳, 使用全自动数码凝胶图像分析系统观察特异性扩增产物并拍照记录。
1.3.4 灵敏度检测 将标准质粒和4种疟原虫阳性标本梯度倍比稀释为103、102、101、1、10-1和10-2 copies/μ L, 以此为模板进行RAA核酸扩增, 检测该方法的最低检测下限。
1.3.5 特异度检验 同时以其他输血传播寄生虫为模板, 包括婴儿利士曼原虫、杜氏利士曼原虫、刚地弓形虫、溶组织阿米巴虫、犬吉氏巴贝西虫、田鼠巴贝虫; 以4种疟原虫阳性标本为阳性对照, 以健康献血者全血DNA为空白对照。进行RAA扩增, 评价其特异性。
1.3.6 献血者核酸样本检测 利用本课题组前期发表文献[8]的疟原虫无症状感染献血者的血液标本和经荧光定量PCR检测阴性的团体献血的东南亚留学生血液标本[9]进行临床标本验证。
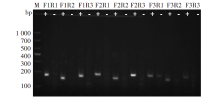
两两组合共为9对引物的扩增结果如图1所示, 其中第2对引物(F1R2)利用103copies/μ L的标准质粒作为模板进行扩增, 扩增产物大小约为144 bp, 条带清晰且单一, 且阴性对照无扩增; 其余引物对虽扩增出阳性条带, 但阴性对照均有少量条带出现, 因此说明第2对引物(F1R2)扩增效率高且特异性良好, 由此确定该对引物对为最佳。
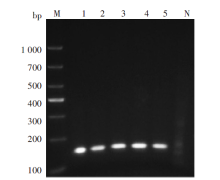
将标准质粒和4种疟原虫阳性标本用预先确定好的最佳引物对进行RAA扩增, 扩增结果如图2所示, 扩增产物大小正确约为144 bp, 产物条带清晰且单一。健康献血者全血DNA阴性对照无条带。提示整个扩增体系可以用于后续实验。
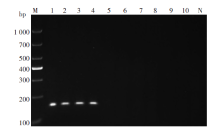
将标准质粒(总拷贝数为4.11× 1011 coppies)倍比稀释到10-2 copies/μ L , 以103、102、101、1、10-1和10-26个梯度为模版进行RAA扩增, 扩增结果如图3A, 可见标准质粒的RAA最低检测限可到10-2 copies/μ L , 且阴性对照无扩增。分别将已知浓度的恶性疟原虫(P.f) 45 811 copies/μ L、间日疟原虫(P.v) 11 043 copies/μ L、 三日疟原虫(P.m) 4 066 copies/μ L 、卵形疟原虫(P.o) 7 824 copies/μ L 阳性标本同样倍比稀释到最低10-2 copies/μ L, RAA扩增结果如图3B~3E。P.f 、P.v和P.o基因组能够扩增的有效浓度均为102 copies/μ L, 而P.m基因组能够扩增的有效浓度为10 copies/μ L, 且阴性对照均无扩增。
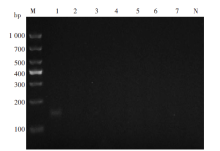
以4种疟原虫阳性标本和其他6种输血传播寄生虫提取的DNA为模板进行RAA, 结果显示只有疟原虫阳性标本扩增出阳性条带, 其余均为阴性(图4)。说明本RAA检测体系特异性良好, 未与其他输血传播寄生虫产生交叉反应。
对1例疟原虫无症状感染献血者的血液标本和6例经荧光定量PCR检测阴性的团体献血者血液标本进行RAA检测, 无症状感染者扩增出目的条带, 证明本RAA检测方法有效; 6例外籍献血者标本均未扩增出目的条带, 提示为疟原虫阴性(图5)。
对于疟疾的检测, 目前常用的诊断方法包括血涂片镜检、应用快速诊断试剂盒(RDT)和分子诊断。血涂片需同时进行厚层和薄层涂片, 然后进行Giemsa染色, 以便在显微镜下识别疟原虫的存在[10]。然而, 血涂片很耗时, 仅染色过程就需要45 min, 而一名训练有素的显微镜专家仍需要15~30 min才能对一张血片进行显微镜检查[11]。血涂片镜检的灵敏度一般为寄生虫100~500 个/μ L[12], 而在一些即将消灭疟疾的国家疟疾流行率很低, 寄生虫通常低于100个/μ L[13]。此外, 厚层涂片很难识别疟疾的类型, 而薄层涂片如果感染密度低则很难确认诊断。虽然RDT比镜检更便宜、更快, 结果可在20 min内确认, 但灵敏度(寄生虫200个/μ L左右)被证实低于其他诊断方法[14]。比利时一项研究显示, 大约10%的恶性疟原虫感染患者的寄生虫密度低于100个/μ L , 即在镜检和RDT的检测下限范围外[15]。聚合酶链式反应(PCR)在疟疾诊断方法中具有最高的灵敏度和特异度, 可以识别疟原虫, 也可以区分不同的物种。然而, PCR循环大约需要3 h, 需要具有热循环能力的昂贵设备和熟练的专业人员[10]。因此, 为了克服这些限制, 本研究建立了一种RAA等温扩增技术检测疟原虫的分子诊断方法。
RAA是一种新的等温扩增技术, 具有快速、简便、成本低等优点, 非常适合临床应用。在该方法中, 重组酶(来自大肠杆菌)和引物形成一个蛋白质-DNA复合体, 可以与双链DNA靶标中的同源序列结合。一旦引物定位到同源序列, 就会发生链式交换反应, 形成并启动DNA合成, 模板上的靶区将被指数级扩增。扩增过程在恒温条件下(一般为37~42 ℃)15~ 30 min内即可完成[16]。本研究中建立的RAA疟原虫检测方法在37 ℃恒温条件下20 min完成, 与其他方法相比, 显著节省了周转时间。
近年来, 针对疟原虫检测中应用较为广泛的主要有LAMP和RPA, 但这两种技术本身存在的缺点限制了其进一步发展。一套LAMP体系中包含6条引物, 引物设计要求较高且容易引起引物自身的非特异性结合。多重引物还会增加引物在总反应体系中的总量, 也会导致误诊[5]。最重要的是LAMP产物经琼脂糖凝胶电泳检测呈梯度条带, 不易与特异性扩增区分[17]。RPA技术的缺点主要在于引物的设计和筛选复杂、引物和探针较长, 无法检测短核酸序列、琼脂糖凝胶电泳检测时, 必须对产物进行纯化等[18]。目前国内外关于RAA技术应用疟原虫检测的研究虽然已有报道[17], 但未对不同种类的疟原虫检测能力进行评估。本研究建立的RAA检测体系, 对标准质粒的检测下限为 10-2 copies/μ L, P.f、P.v和P.o为102 copies/μ L, P.m为10 copies/μ L。研究表明, 每一个间日疟原虫和卵形疟原虫有4~8 copies 18S rRNA [19], 因此估算本研究中建立的RAA检测体系检测灵敏度约为:标准质粒0.001 25~0.002 5个/μ L, P.f 、P.v和P.o寄生虫载量12.5~25 个/μ L, P.m:1.25~2.5个/μ L。由于疟疾寄生虫血症血液中寄生虫载量为1 000个/μ L[20], 因此本RAA体系可适用于临床诊断。2016年, 郑伟等[17]针对疟原虫18S rRNA基因组序列, 设计了检测疟原虫的通用引物, 并采用RAA技术成功建立了疟原虫的检测方法, 但未对该方法的灵敏度和特异度进行评价。此后郑伟等[21]又在RAA的基础上设计了实时荧光检测, 最低可检测到100 copies的阳性质粒。相比之下, 本研究所建立的RAA体系在灵敏度、特异度以及操作简便性上均有提升。在Moonga等的研究中[1], 使用LAMP法对疟原虫线粒体细胞色素b基因进行检测, 并比较了单一和多重LAMP的灵敏度, 结果显示多重LAMP对混合靶标的灵敏度(1 000 copies/μ L)比单一靶标模板(100 copies/μ L)低10倍, 差异可能归因于多重反应中试剂对于混合目标模板的竞争性。Barazorda等[22]比较了基于实时荧光和孔雀石绿[a malachite-green (MG)-based]的两种LAMP技术对间日疟原虫和恶性疟原虫检测的性能差异, 结果显示两种方法对属特异性的最低检测限均为寄生虫载量2.5个/μ L, 对恶性疟原虫和间日疟原虫的最低检测限分别为寄生虫载量5个/μ L和10 个/μ L。另一项研究使用商品化疟疾试剂盒分别与聚合酶链式反应热循环仪和非仪表式核酸扩增(NINA)平台加热器相结合的研究发现, 间日疟原虫的最低检测限为寄生虫载量5个/μ L和 1个/μ L[23]。而使用同样的LAMP试剂盒与超快速提取方法相结合, 检测限为寄生虫1个/μ L, 而当仅用于卵形疟原虫感染样本时, 检测限可达到寄生虫0.8~ 2个/μ L[24, 25]。在使用RPA检测诺氏疟原虫的研究中, 最低检测限为1个拷贝的标准质粒且特异性良好[26]。另一项针对恶性疟原虫28S rRNA基因的RPA结合侧向流动试验超灵敏检测研究中表明[27], 基于Logistic回归模型, RT-RPA检测下限为每毫升64个寄生虫(95%置信区间), 在无症状者的筛查中, 特异度可达到90%。以上研究说明, 针对不同靶基因的不同等温扩增技术在灵敏度和特异度上仍有很大差异。本课题组前期已建立了荧光定量PCR技术检测疟原虫的方法[9], 虽灵敏度较本RAA检测方法更高, 但前者仅PCR程序就要耗时2 h左右, 加之所需试剂和实验仪器较为复杂, 在资源条件相对不足的偏远地区, RAA方法操作更方便、快捷和经济; 如果与荧光探针或者试纸条结合, 可以实现可视化检测。因此, 在消除疟疾的大背景下, 优化现有方法、开发灵敏度更高、操作更简便的检测技术用于资源匮乏和经济欠发达地区是研究的主要方向。
本研究建立的RAA检测方法以其他6种输血传播寄生虫核酸为模板进行验证, 结果表明未产生交叉反应; 对可能来自疟原虫流行区的外籍献血者标本进行了筛查, 结果与荧光定量PCR的检测结果完全一致, 说明本方法具有良好的特异度, 可有效避免漏诊和误判。RAA检测方法不需要复杂的实验室环境、昂贵的设备, 甚至可以用便携式设备来实现, 其运行成本也比荧光定量PCR等方法低。后续若再结合简单的DNA提取方法以及可视化辅助手段, 将会在一些初级诊断实验室中具有较高的应用价值, 给基层偏远医院的临床检测和治疗提供很大的帮助。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|