作者简介:陈俊瑶(1974—),女,本科,副主任检验师,研究方向:临床微生物及分子生物检验。
目的 通过全基因组测序技术(whole genome sequencing,WGS)检测耐碳青霉烯肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumonia, CRKP)的耐药基因及毒力基因,了解本院CRKP的分布及耐药情况,为临床治疗和预防耐药菌的产生提供理论依据。方法 收集甘肃省肿瘤医院2019年6月至2021年6月临床分离的耐碳青霉烯肺炎克雷伯菌,用全自动细菌鉴定仪进行细菌鉴定和抗菌药物敏感试验,用改良碳青霉烯灭活试验(mCIM)确认所筛选出的菌株是否产碳青霉烯酶,通过全基因组测序分析研究CRKP菌株的耐药基因种类和分布情况以及毒力基因类型和毒力基因位点。结果 23株CRKP分离自4个不同的临床科室,标本主要来源于痰液和血液,药敏结果显示所有菌株对碳青霉烯类、头孢菌素类、青霉素类及含β-内酰胺酶抑制剂类抗菌药物均耐药,对环丙沙星、阿米卡星和复方新诺明部分耐药。基因组测序分析显示:23株CRKP中,17株为ST11型,6株为ST23型。CRKP的荚膜型(KL)均为KL64,一致性均在99.9%以上。23株CRKP均携带 blaKPC-2,此外还有3株菌同时携带 blaNDM-1;还检测出了不同型别的β-内酰胺类(TEM、SHV、CTX-M等)、氨基糖苷类(rmtB)、磷霉素类(fosA)、喹诺酮类(qnr)、四环素(tet)、磺胺类(sul)、甲氧嘧啶(dfrA)等耐药基因;检测出5株耐碳青霉烯高毒力肺炎克雷伯菌,携带耐碳青霉烯酶基因同时携带高毒力质粒及多种亚型;23株CRKP中毒力质粒相关的毒力因子 rmpA和 rmpA2的携带率分别为21.7%和60.9%。结论 23株 CRKP菌株以重症医学科和呼吸肿瘤内科检出率最高;标本类型以痰液和血液为主,提示呼吸道和血流感染为 CRKP 感染的防控重点;23 株 CRKP 均携带 blaKPC-2;CRKP 菌株 MLST 分型以 ST11为主,占73.9%;荚膜K抗原类型均为KL64。
Objectives For the distribution and resistance of Klebsiella pneumonia to carbapenem in our hospital, its drug resistance and virulence genes were detected by whole genome sequencing (WGS) to provide clinical therapy and prevention from drug-resistant bacteria.Methods The bacterial identification and antimicrobial susceptibility tests were conducted with automatic bacterial identification instrument for clinical isolates of carbapenem-resistant Klebsiella pneumoniae (CRKP) in our hospital from June 2019 to June 2021. The carbapenemases produced by the isolates was detected using modified carbapenem inactivation test (mCIM). The types and distribution of drug resistance genes, virulence gene types and loci of CRKP strains were studied by whole-genome sequencing analysis.Results There were 23 CRKP strains were isolated from sample of sputum and blood in 4 clinical departments. The drug susceptibility results showed that all strains were resistant to carbapenems, cephalosporins, penicillins and β-lactamase inhibitors, while part of them resistant to ciprofloxacin, amikacin and cotrimoxazole. For genome sequencing analysis, 17 out of 23 CRKP strains were ST11 type, and 6 strains were ST23 type; The capsule type (KL) was KL64 for all CRKP with the consistency of above 99.9%; All 23 CRKP strains carried blaKPC-2, and 3 strains also carried blaNDM-1; the resistance genes were detected such as β-lactams (TEM, SHV, CTX-M, etc.), aminoglycosides (rmtB, etc.), fosfomycin (fosA), quinolones (qnr), tetracycline (tet), sulfonamides (sul), and methoxypyrim (dfrA). 5 CRKP strains were hypervirulent carrying carbapenemase-resistant genes as well as high virulence plasmid and various subtypes. Virulence plasmid-related virulence factors rmpA and rmpA2 were 21.7% and 60.9% respectively in 23 strains of CRKP.Conclusions The detection rate of 23 STRAINS of CRKP was the highest in intensive care unit and respiratory oncology department. The main specimen types were sputum and blood, suggesting that respiratory and bloodstream infection are the focus of CRKP infection prevention. All 23 CRKP strains carried blaKPC-2 and 3 strains also carried blaNDM-1. MLST of CRKP strain was mainly ST11, accounting for 73.9%. The capsule K antigen types were KL64.
肺炎克雷伯菌(Klebsiella pneumoniae, KPN)为临床常见院内感染条件致病菌之一, 主要引起肺部感染、败血症以及尿路感染等疾病。目前临床治疗KPN感染最有利的武器仍是碳青霉烯类抗菌药物, 该药多用于治疗产超广谱β -内酰胺酶(extended spectrum β -lactamases, ESBLs)及头孢菌素酶(AmpC酶)等多重耐药菌株引起的严重感染[1], 其能通过抑制细菌细胞壁青霉素结合蛋白以阻断细菌细胞壁粘肽合成, 从而使细菌细胞壁缺损, 达到杀灭细菌的目的[2, 3]。近年来, 随着碳青霉烯类抗菌药物在临床上的广泛使用, 耐碳青霉烯肺炎克雷伯菌(carbapenem-resistant Klebsiella pneumonia, CRKP)院内感染的发生率也越来越高, 国内外研究报道克雷伯菌属对碳青霉烯类抗菌药物耐药率呈大幅度增加[4, 5, 6, 7, 8], 肺炎克雷伯菌耐药表型与毒力基因检测值得进一步关注, 已有研究显示不同地区KPN分离株耐药表型和毒力基因携带情况存在差异[9, 10]。给临床治疗和医院感染管理工作带来巨大挑战, 对我国的医疗安全及公共卫生构成极大威胁。本研究回顾性分析甘肃省肿瘤医院3年来住院患者送检标本中分离的CRKP的临床特征和耐药情况, 并对其耐药基因和毒力基因进行分析。
1.1.1 菌株来源 收集2019年6月至2021年6月于临床标本中首次分离的非重复肺炎克雷伯菌, 筛选CRKP菌株, 并分析相关临床资料、危险因素等。质控菌株为大肠埃希菌ATCC 25922、肺炎克雷伯菌ATCC 700603(购自于卫生部临床检验中心)。
1.1.2 试剂及仪器 所有菌株均采用MiroScan WalkAway40全自动微生物鉴定及药敏分析仪进行菌种鉴定和药物敏感试验, 用改良碳青霉烯灭活试验(mCIM)方法检测碳青霉烯酶[11], Mueller-Hinton培养基和药敏纸片购自英国OXOID公司。
MicroScan WalkAway40全自动微生物鉴定及药敏分析仪进行菌种鉴定和药物敏感试验, 部分抗菌药物敏感试验用E试验法做补充, 结果参照美国临床实验室标准化协会(CLSI)标准第31版[12](头孢哌酮/舒巴坦药物敏感试验结果参照头孢哌酮), 替加环素结果参照美国食品药品监督管理局(FDA)药物敏感试验判定标准[13]; 用mCIM试验确认肺炎克雷伯菌是否产碳青霉烯酶。23株CRKP菌株送至深圳市人民医院呼吸病研究所周凯博士团队进行全基因组测序。
用WHONET 5.6软件对药敏结果进行统计; 用SPAdes(v3.13.0)组装二代测序数据; 用PubMLST数据库查看菌株的ST型; 用Resfinder(v3.2)数据库分析检测基因组中的耐药基因; 用VFDB数据库分析检测基因组中的毒力相关基因; 用Kleborate (v0.4.0)读取ICEKp相关的毒力位点:ybt、clb; 毒力质粒相关的位点:iro、iuc、rmpA、rmpA2。
1 087株肺炎克雷伯菌中检出23株CRKP菌株, 其中男性患者13例, 女性患者10例, 平均年龄65岁, 23例患者均有恶性肿瘤病史, 平均住院天数14 d以上。标本来源:8株(8/23, 34.8%)痰液, 6株(6/23, 26.1%)血液, 4株(4/23, 17.4%)手术后伤口分泌物, 3株(3/23, 13.0%)胸腹水, 2株(2/23, 8.7%)尿液。23株CRKP菌株分离自4个不同的临床科室, 其中重症医学科8株, 呼吸肿瘤内科8株, 放疗科4株, 血液科3株。
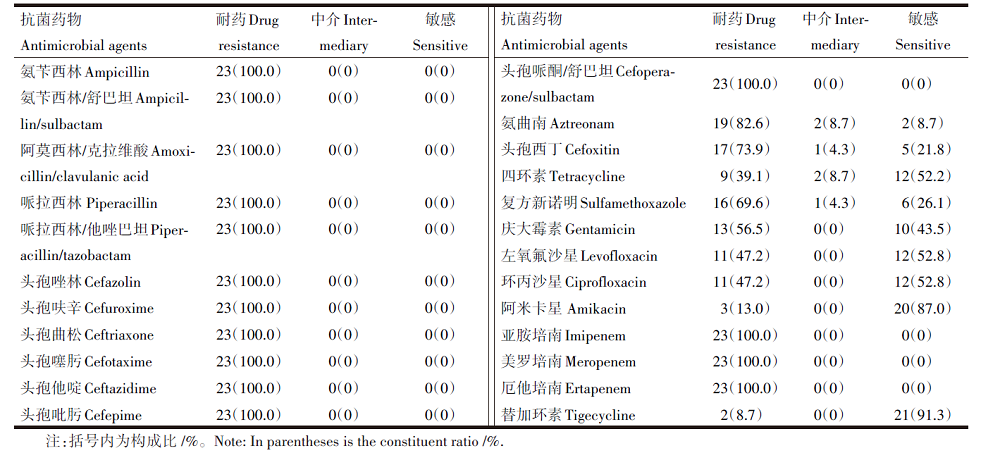
23株CRKP菌株对青霉素类、头孢菌素类和碳青霉烯类抗菌药物耐药率均为100%, 同时mCIM试验阳性, 对各种抗菌药物的耐药率见表1。
| 表1 23株CRKP菌株抗菌药物敏感试验结果 Table 1 Results of 23 strains of CRKP susceptibility test |
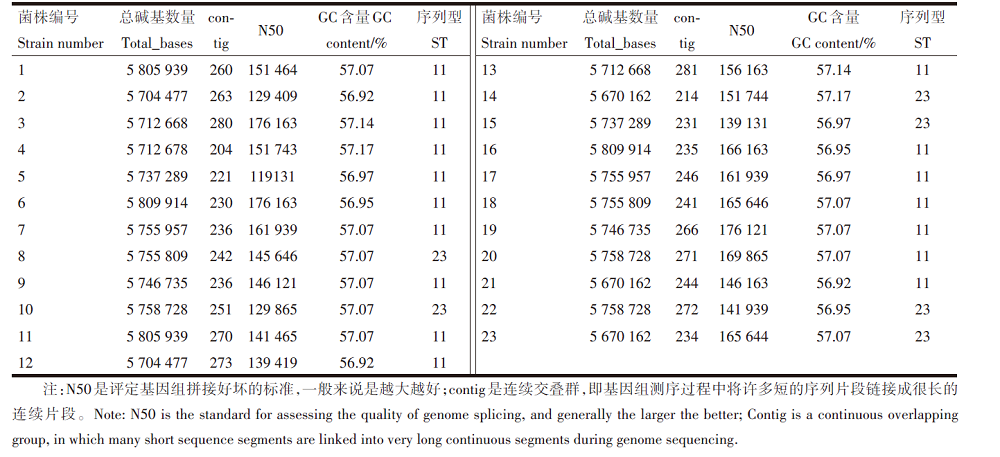
23株CRKP菌株检测出ST11和ST23两个不同的ST型, 其中ST11型最为常见, 占73.9%(17/23), ST23型占26.1%(6/23), 见表2。
| 表2 23株CRKP菌株MLST分型和基因组组装结果 Table 2 MLST typing and genome assembly of 23 CRKP strains |
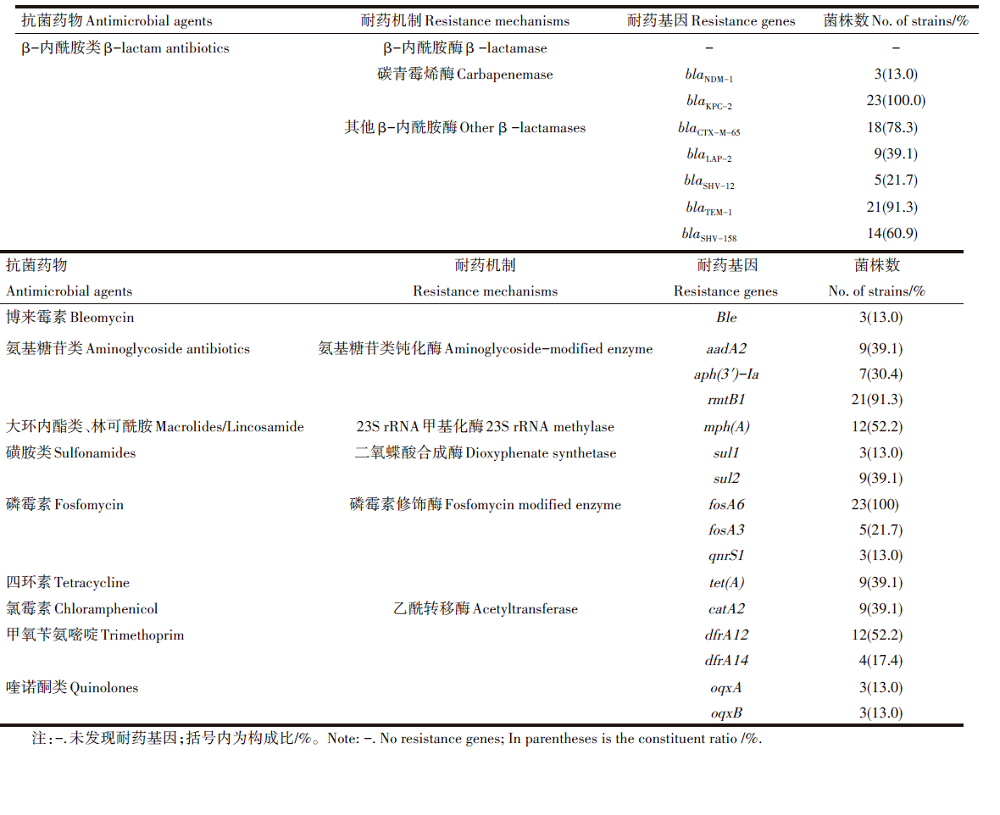
耐药基因分析结果显示:23株CRKP均携带blaKPC-2, 此外还有3株菌同时携带blaNDM-1; 所有菌株均携带fosA6, 还有部分菌株同时携带blaCTX-M-65(18/23, 78.3%)和检出blaSHV-158(14/23, 60.9%)基因。耐药基因的种类及分布情况见表3。
| 表3 23株CRKP菌株耐药基因分布结果 Table 3 Results of drug resistance gene distribution in 23 strains of CRKP |
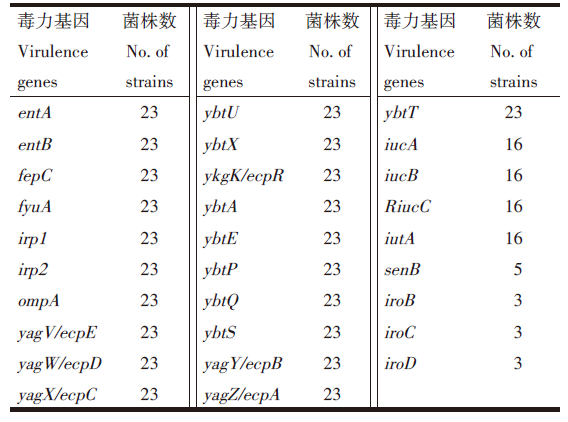
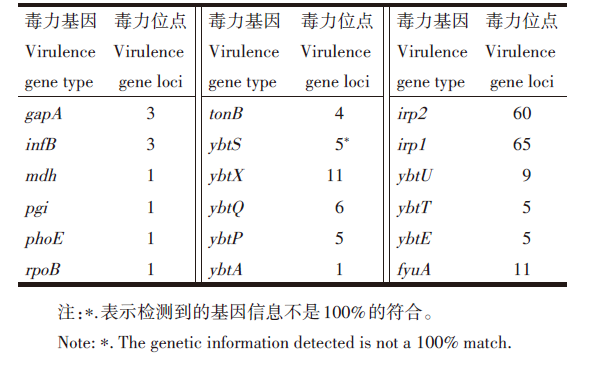
23株CRKP菌株毒力基因分布情况与相关的毒力基因类型和毒力基因位点表达(表4~5); 毒力基因分析显示pLVPK-like毒力质粒相关的毒力因子rmpA携带5株、rmpA2携带14株, 在23株CRKP菌株中的携带率分别为21.7%、60.9%。荚膜分型显示23株CRKP主要为KL64型; 23株CRKP毒力质粒相关位点的表达见表6。
| 表4 23株CRKP菌株毒力基因分布情况 Table 4 Distribution of virulence genes in 23 strains of CRKP |
| 表5 23株CRKP菌株相关的毒力基因类型和毒力基因位点 Table 5 Virulence gene types and loci associated with 23 strains of CRKP |
| 表6 23株CRKP菌株荚膜分型和毒力质粒相关的位点 Table 6 Loci associated with virulence plasmids and capsular typing of 23 strains of CRKP |
CRKP在世界范围内的传播对免疫力低下的住院患者, 尤其是肿瘤患者构成了越来越大的威胁[14], CRKP感染的危险因素包括使用过高级别抗菌药物、抗菌药物使用时间大于7 d、接受过侵袭性诊疗操作以及具有基础疾病的患者等[15]。本研究中的23株CRKP均来自免疫功能低下的恶性肿瘤患者, 平均年龄65岁, 住院时间都超过14 d, 均使用过三代头孢或碳青霉烯抗生素, 且有8人接受手术治疗。23株CRKP主要分离自痰液和血液标本, 有16株来自重症医学科和呼吸肿瘤内科, 表明CRKP主要在上述两科室流行, 这一研究与国内其他医院研究结果类似[16], 因此应须加强重症医学科和呼吸科的院感防控措施, 控制耐药菌的传播。
本研究中23株CRKP对各类抗生素都具有较强的耐药性, 对青霉素类、头孢类、碳青霉烯类和β -内酰胺抑制剂类抗生素全部耐药, 这与国内其他医院先前的报道基本一致[17]。
对单环类、磺胺类、喹诺酮类抗生素部分耐药, 对替加环素和阿米卡星的耐药率较低, 分别为8.7%和13.0%, 低于美国的相关报道(46%)[18], 但许多医院目前并未常规开展替加环素的药物敏感试验, 所以需警惕耐替加环素菌株的发展, 同时重视该类菌株的耐药机制研究。常规药敏结果中没有磷霉素检测结果, 故而需加强常规药物敏感试验的关注。
肺炎克雷伯菌的碳青霉烯类耐药机制包括:碳青霉烯酶的产生; 膜孔蛋白的改变或缺失, 合并高水平产 AmpC 酶或 ESBLs 酶; 外排泵高表达合并高水平产 AmpC 酶或 ESBLs 酶[19]。肺炎克雷伯菌对碳青霉烯类抗菌药物耐药的主要机制是产碳青霉烯酶, 到目前为止, 肺炎克雷伯菌中发现了多种碳青霉烯酶, 如KPC、NDM、IMP等, 不同的型别在全球的分布也具有地域性分布特点, 我国流行菌株主要以KPC-2型居多[17]。本研究中的CRKP菌株均携带blaKPC-2, 还有3株菌同时携带blaNDM-1, 此外还检测出了多种其他耐药基因, 如其他β -内酰胺酶耐药基因、喹诺酮类耐药基因、磺胺类耐药基因和氨基糖苷类耐药基因等共23种, 其中占比在70%以上的耐药基因有:其他β -内酰胺酶耐药基因blaCTX-M-65(78.3%)、blaTEM-1(91.3%), 氨基糖苷类耐药基因rmtB1(91.3%)和磷霉素耐药基因fosA6(100%)。未检测到OXA-48-like 型和IMP型碳青霉烯酶基因, 并不能说明我院没有此流行株, 可能和这次研究纳入菌株数量较少有关。
本研究选用MLST对23株CRKP进行流行病学研究。MLST为多位点序列分型, 是一种基于核酸序列测定的细菌分型方法。能较好的反映微生物地区进化和菌群生物学变异, 有助于分析不同序列型在同一家医院、地区的局部流行趋势, 分析菌株是否产生变异, 适合微生物长期和短期内的流行病学调查。本研究分型结果显示:23株CRKP共分为2种ST型, 17株为ST11型, 占73.9%, 6株为ST23型, 占26.1%。ST11为我院CRKP主要ST型, 该类型是中国地区CRKP的主要流行克隆群[20]。
已知的肺炎克雷伯菌毒力因子包括荚膜、脂多糖、铁载体和菌毛, 肺炎克雷伯菌的荚膜由菌株特异性的荚膜多糖组成, 也叫做K抗原, 是重要的毒力因子。23株CRKP检测到多种毒力基因并呈现多样性, 5株同时携带rmpA和rmpA2; 14株携带rmpA2, 有共同携带现象, 如有些菌株同时携带rmpA、iuc和iron, 或者同时携带rmpA和iuc等, 未见携带clb菌株。本文中有5株为耐碳青霉烯高毒力肺炎克雷伯菌(carbpenem-resistant hypervirulent Klebsiella pneumoniae, CR-hvKP), 携带耐碳青霉烯酶基因同时携带高毒力质粒及多种亚型, CR-hvKP菌株很可能借助ST11泛流行特性肆意扩散, 导致多株细菌高耐药的同时表达高毒力。说明这5株CR-hvKP中存在多种抗菌药物耐药的菌株。因此临床科室应加强对CRKP感染患者的观察, 注重患者的呼吸道管理, 避免细菌定植, 规范使用抗菌药物, 采取严格的消毒隔离措施, 对合并基础疾病与入侵性操作的患者, 应加强监测, 注重提高患者机体免疫力, 严格遵守无菌操作, 尽可能降低感染发生风险[21], 遏制CR-hvKP菌株在医院内的传播与流行。
此次纳入研究的CRKP菌株数量相对较少, 且具有一定的局限性, 后续将继续收集临床分离菌株, 密切监控CRKP菌株特别是KL64-ST11型的流行趋势, 为制定相应的感染控制措施, 防控CRKP菌株在院内传播流行提供重要参考数据。
志谢 深圳市人民医院呼吸病研究所周凯博士及其团队帮助进行菌株耐药基因和毒力基因检测
利益冲突声明 所有作者声明不存在利益冲突
编辑:邢翀
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|