作者简介:赵梅(1982—),女,硕士,副主任药师,研究方向:心血管药理学、临床药学。
目的 探讨黄芪甲苷Ⅳ(astragaloside Ⅳ, AS-Ⅳ)对低氧诱导的人肺动脉平滑肌细胞增殖和迁移的影响及其相关分子机制。方法 运用实时定量PCR和Western blot检测增殖细胞核抗原(PCNA) mRNA和蛋白的表达水平;CCK-8和EdU试验检测细胞活性和增殖;Transwell迁移试验检测细胞迁移。结果 低氧处理人肺动脉平滑肌细胞24 h后,PCNA mRNA和蛋白表达量显著增加( P<0.05)。低氧刺激能显著增加人肺动脉平滑肌细胞的活性和增殖( P<0.05)。此外,低氧刺激还增强了人肺动脉平滑肌细胞的迁移能力( P<0.05)。AS-Ⅳ可下调低氧诱导的人肺动脉平滑肌细胞PNCA mRNA和蛋白的表达水平,抑制细胞活性、增殖以及迁移能力,其抑制作用呈浓度依赖性( P<0.05)。低氧诱导能够激活人肺动脉平滑肌细胞Wnt/β-catenin信号通路( P<0.05);而AS-Ⅳ能够浓度依赖性的抑制低氧诱导人肺动脉平滑肌细胞的Wnt/β-catenin信号通路的活性( P<0.05)。Wnt/β-catenin信号通路抑制剂XAV939可降低低氧诱导的人肺动脉平滑肌细胞PNCA mRNA和蛋白的的表达水平,同时降低低氧诱导的人肺动脉平滑肌细胞活性、增殖以及迁移能力( P<0.05)。Wnt/β-catenin 信号转导激动剂LiCl处理可恢复AS-Ⅳ处理下调的人肺动脉平滑肌细胞PCNA mRNA和蛋白的表达量( P<0.05);AS-Ⅳ对低氧处理的人肺动脉平滑肌细胞增殖和迁移的抑制作用也被LiCl 处理明显减弱( P<0.05)。结论 研究表明AS-Ⅳ能够逆转低氧诱导的人肺动脉平滑肌细胞的增殖和迁移,此作用可能是通过调控Wnt/β-catenin信号通路实现的。
Objective This study aims to determine the effects of astragaloside Ⅳ (AS-Ⅳ) treatment on the viability, proliferation and migration of hypoxia-stimulated human pulmonary arterial smooth muscle cells (PASMCs), and to explore the underlying molecular mechanisms.Methods The mRNA and protein expression levels of proliferating cell nuclear antigen (PCNA) were determined qRT-PCR and Western blot assays, respectively. Cell viability and cell proliferation were determined by CCK-8 and 5-ethynyl-2′-deoxyuridine (EdU) cell proliferation assays, respectively. The cell migration was determined by Transwell migration assay.Results Hypoxia stimulation up-regulated the mRNA and protein expression of PCNA in PASMCs ( P<0.05); hypoxia stimulation significantly promoted PASMC viability and proliferation ( P<0.05), and also increased the migration of PASMCs ( P<0.05). AS-Ⅳ concentration-dependently down-regulated the mRNA expression and protein expression of PCNA ( P<0.05), inhibited the viability, proliferation and migration of PASMCs under hypoxia ( P<0.05). Hypoxia stimulation activated the Wnt/β-catenin signaling in PASMCs; while AS-Ⅳ concentration-dependently repressed the Wnt/β-catenin signaling in the hypoxia-stimulated PASMCs ( P<0.05). Moreover, the treatment of XAV393, a Wnt/β-catenin inhibitor, attenuated the hypoxia-induced increase in the viability, proliferation and migration of PASMCs ( P<0.05). The treatment of LiCl, a Wnt/β-catenin activator, restored the mRNA and protein expression levels of PCNA in the hypoxia-stimulated PASMCs with AS-Ⅳ treatment ( P<0.05). The inhibitory effects of AS-Ⅳ treatment on the viability, proliferation and migration of PASMCs under hypoxia was attenuated by LiCl treatment ( P<0.05).Conclusion Our results indicate that AS-Ⅳ reversed hypoxia-induced proliferation and migration of human pulmonary artery smooth muscle cells, which may be by regulating the Wnt/β-catenin signaling pathway.
肺动脉高压(pulmonary artery hypertension, PAH)是一种致命性疾病, 发病表现年轻化、临床症状不典型, 病因复杂和死亡率高, 经常规治疗后5年生存率仅为20.8%, 素有“ 心血管系统恶性肿瘤” 之称[1]。高原地区慢性阻塞性肺疾病(COPD)患者肺动脉高压发生率较高[2]。肺动脉高压的主要病理基础是肺动脉平滑肌细胞( PASMCs)异常增殖/迁移[3]。因此抑制PASMCs的增殖/迁移, 有可能给预防和治疗该疾病带来更好的途径。黄芪在临床上常用于高血压、肺动脉高压治疗, 黄芪甲苷Ⅳ (AS-Ⅳ )是其主要生物活性成分[4]。AS-Ⅳ 可通过调控p38-MAPK信号通路抑制血小板衍生生长因子诱导的血管平滑肌细胞的增殖和迁移[5]。AS-Ⅳ 也可通过改善炎症和肺动脉重塑来阻断单克尿酚诱导的肺动脉高压[6]; 也有研究发现AS-Ⅳ 能够减弱由核苷酸结合寡聚化结构域(NOD)样受体热蛋白结构域相关蛋白3(NOD-like receptor pyrin domain containing 3, NLRP3)/钙蛋白酶1抗体(calpain-1)介导的炎症反从而减缓大鼠肺动脉高压的发展[7]。在分子机理方面, AS-Ⅳ 通过靶向Wnt/β -catenin信号来调控神经胶质瘤细胞的上皮间质转化[8]; 同时AS-Ⅳ 可以抑制单侧输尿管梗阻大鼠的Wnt/β -catenin信号上调[9]。目前尚无研究去探讨AS-Ⅳ 通过靶向Wnt/β -catenin信号通路来调控肺动脉平滑肌细胞的生物学行为。本研究旨在探讨AS-Ⅳ 对低氧诱导下人肺动脉平滑肌细胞增殖/迁移的影响及其可能的分子机制, 为AS-Ⅳ 可望作为有效药物用于缺氧性肺动脉高压治疗提供理论参考。
人肺动脉平滑肌细胞(PASMCs)购买于美国ATCC公司; DMEM- F12培养基、胎牛血清购买于美国Thermo Fisher Scientific 公司; CCK-8、EdU试剂盒购买北京碧云天生物科技有限公司; PCR相关试剂盒购买日本Takara公司; XAV393(Wnt/β -catenin信号通路抑制剂)、LiCl(Wnt/β -catenin信号通路激活剂)购于美国Sigma公司; 兔抗PCNA、兔抗b-catenin 、兔抗GSK-3b、兔抗cyclin D1、兔抗c-myc、兔抗b-actin多克隆抗体以及羊抗兔二抗购于美国Abcam公司。低氧培养箱以及ABI 7300 PCR系统购于美国Thermo Fisher Scientific公司。
人PASMCs于含有10%胎牛血清(FBS)的DMEM-F12和1%青霉素/链霉素培养液中培养, 细胞在37 ℃的5% CO2的饱和湿度的培养箱中, 每2天更换1次培养基, 每4~5天定期传代1次, 第5代用于试验。
第一组实验:分别用常氧(21% O2和5% CO2)、低氧(3% O2、5% CO2和92% N2)处理人PASMCs, 24 h后收集细胞进行相关体外的实验。第二组实验:分别用常氧(21% O2和5% CO2)、低氧(3% O2、5% CO2和92% N2)、低氧(3% O2、5% CO2和92% N2)联合不同浓度的AS-Ⅳ (25、50、100 nmol/L)处理人PASMCs, 24 h后收集细胞进行相关实验; 第三组实验:分别用常氧(21% O2和5% CO2)、低氧(3% O2、5% CO2和92% N2)或者低氧(3% O2、5% CO2和92% N2)联合XAV393处理人PASMCs, 24 h后收集细胞进行相关实验; 第四组实验:分别用常氧(21% O2和5% CO2)、低氧(3% O2、5% CO2和92% N2)、低氧(3% O2、5% CO2 和92% N2)联合AS-Ⅳ (100 nmol/L)、低氧(3% O2、5% CO2和92% N2)联合AS-Ⅳ (100 nmol/L)和LiCl(2 mmol/L)处理人PASMCs, 24 h后收集细胞进行相关实验。
人PASMCs培养在96孔板上, 细胞数为1× 104个/孔, 经不同时间处理后, 在室温下用CCK-8溶液10 μ L处理2 h, 用微孔板阅读器测量 490 nm波长处的光密度, 以评价细胞活力。每组设置3个复孔, 试验重复3次。
取处理24 h后的人PASMCs, 调整细胞密度为3× 105个/mL, Transwell小室(膜的孔径为8 µ m)上室中加入200 µ L的细胞悬液, 下室加入550 µ L含10% FBS的培养基, 37 ℃孵育 36 h, PBS洗细胞3次, 4%多聚甲醛固定10 min, 结晶紫染色5 min, 再用PBS洗涤3次, 显微镜下计算每个视野的平均细胞数量。
以细胞数为5 000个/孔接种于96孔板, 继续培养24 h, 按照EdU检测试剂盒说明书进行染色, 经Olympus IX7I型倒置相差荧光显微镜采集图像(× 200), 阳性细胞胞核经激发后呈绿色荧光、DAPI复染的胞核经激发呈蓝色荧光, 计算EdU阳性细胞率, 公式为EdU阳性细胞率(%) = EdU阳性细胞数/总细胞数× 100%。重复实验3次, 取平均值。
依据Trizol说明书提取各组细胞中的总RNA, 测定RNA样品的纯度并定量。取2 µ g总RNA经Reverse transcriptase逆转录至终体积为20 µ L的cDNA, 然后依照说明书采用SYBR Green实时荧光定量PCR试剂盒, 通过ABI 7300 PCR系统检测PCNA的表达。GAPDH作为内参, 采用2-Δ Δ Ct法分析PCNA mRNA表达量。PCNA上游引物:5'-CCATCCT CAAGAAGGTGTTGG-3', PCNA下游引物:5'-GTGTCCCATATCCGCAATTTTAT-3'; GAPDH上游引物:5’ -TGTGGGCATCAATGGATTTGG-3', GAPDH下游引物:5'-ACACCATGTATTCCGGGTCAAT-3'。
利用RIPA裂解液提取细胞蛋白, BCA蛋白定量试剂盒定量后, 调整各组上样蛋白总量至40 µ g, 加入4倍体积的蛋白上样缓冲液, 95 ℃变性5 min, 而后上样进行SDS-PAGE。电泳结束后将蛋白电转至PVDF膜上。用5%脱脂牛奶室温封闭2 h, 按说明书要求加入兔抗PCNA(1∶ 1 000)、兔抗b-catenin(1∶ 1 500)、兔抗GSK-3b(1∶ 1 500)、兔抗cyclin D1(1∶ 1 000)、兔抗c-myc(1∶ 1 000)以及兔抗b-actin(1∶ 3 000)多克隆抗体4 ℃孵育过夜, 复温, TBST洗涤3次, 每次5 min; 加入对应的羊抗兔二抗(1∶ 3 000)温孵育2 h, TBST洗涤3次, 每次10 min, 暗室中显影、定影, 冲洗胶片后经Image J软件(1.80版本)进行蛋白半定量灰度分析。
采用GraphPad Prism软件(6.0版本)进行统计学分析。实验结果以x± s表示。两组数据的组间差异采用t检验, 多组数据之间采用单因素方差分析, 同时采用Bonferroni校正的t检验进行均数组间的两两比较。以P< 0.05为差异有统计学意义。
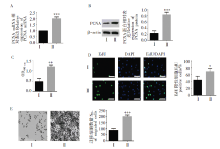
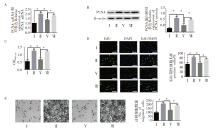
qRT-PCR和Western blot结果显示, 低氧处理人PASMCs 24 h后, PCNA mRNA和蛋白表达量显著增加 (图1A~图1B)。人PASMCS细胞的增殖检测结果表明, 低氧能显著增加490 nm处的EdU阳性细胞数量和增殖指数(OD值)(图1C~图1D)。此外, 低氧还增强了人PASMCs的迁移能力(图1E)。
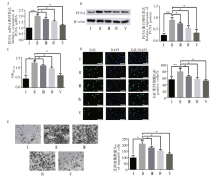
AS-Ⅳ 能够显著降低低氧条件下增加的PCNA mRNA和蛋白的表达量(图2A~图2B), 同时降低EdU阳性细胞的数量, 此抑制作用呈浓度依赖性(图2C)。进一步的CCK-8和Transwell 迁移试验结果显示, AS-Ⅳ 能够有效抑制低氧条件下人PASMCs的活性和迁移, 并呈浓度依赖性(图2D~2E)。
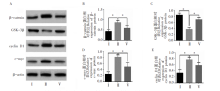
利用Western blot 检测发现低氧处理人PASMCs 24 h后β -catenin、c-myc和cyclin D1蛋白的表达量显著增加, GSK-3β 蛋白表达量降低, 与对照组相比差异有统计学意义。进一步的研究发现AS-Ⅳ 能够下调低氧条件下人PASMCs的β -catenin、c-myc和cyclin D1蛋白的水平, 同时上调其GSK-3β 蛋白的表达水平(图3)。
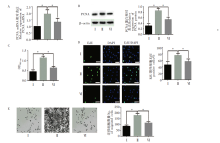
如图4A和4B所示, XAV939显著下调低氧条件下人PASMCs的PCNA mRNA和蛋白的表达水平, 同时降低EdU阳性细胞的数量(图4C)。进一步的CCK-8和Transwell 迁移试验结果显示XAV939能够有效抑制低氧条件下人PASMCs的活性和迁移(图4D~图4E)。
qRT-PCR和Western blot结果表明, AS-Ⅳ 处理降低低氧诱导的PASMCs上调的PCNA mRNA和蛋白的表达量, 而wnt/β -catenin信号转导激动剂LiCl处理可恢复AS-Ⅳ 处理下调的PCNA mRNA和蛋白的表达量(图5A和5B)。此外, AS-Ⅳ 对低氧处理的人PASMCs增殖的抑制作用也被LiCl 处理明显减弱(图5C~5D)。LiCL减弱了AS-Ⅳ 诱导的对低氧处理的PASMCs细胞迁移抑制作用(图5E)。
本研究结果显示低氧刺激能促进人PASMCs增殖和迁移, AS-Ⅳ 浓度依赖性地减弱低氧诱导的人PASMCs高增殖和高迁移。进一步的机制研究表明, 低氧处理激活了人PASMCs wnt/β -catenin信号通路, 而AS-Ⅳ 处理可以抑制 wnt/β - catenin信号通路, 说明AS-Ⅳ 调控低氧下肺动脉平滑肌细胞的增殖和迁移与Wnt/β -catenin信号通路有关。
药理和临床实践研究表明, 黄芪具有免疫调节、心血管保护、抗炎、保肝、抗糖尿病、抗癌和神经保护等作用[10]。在动脉血管相关的疾病中, 血管平滑肌细胞通常是静态的, 并保持在细胞周期的G0/G1期[5]。血管平滑肌细胞增殖在慢性低氧诱导的肺动脉高压中起重要作用[11]。研究发现AS-Ⅳ 能够降低人肺动脉内皮细胞中NLRP‐3、caspase‐1、ASC、IL‐18、IL‐1β 和calpain‐1的表达从而来降低肺动脉高压中的炎症反应[7]。有研究报道, AS-Ⅳ 通过调节CDK2活性, 对血管紧张素Ⅱ 刺激的血管平滑肌细胞增殖有抑制作用, 表明其对血管疾病有改善作用[12]。AS-Ⅳ 也可以通过抑制醛糖还原酶的活性, 促进细胞凋亡, 增加NO的产生和钙离子浓度的途径来抑制异常血管平滑肌细胞的增殖 [13]。Yao等[14]研究也发现AS-Ⅳ 能够靶向通过Notch信号通路减弱缺氧诱导的肺血管重塑。与上述研究一致, 本研究表明AS-Ⅳ 通过调节PCNA的表达以剂量依赖的方式抑制了缺氧诱导的PASMCs增殖和迁移能力的增加。AS-Ⅳ 抑制PASMCs的增殖和迁移过程中, 从而逆转血管重塑并减少对低氧条件下肺动脉内膜的增厚。
有研究报道, AS-Ⅳ 通过各种信号传导途径在细胞增殖、迁移和分化中起重要作用, 包括p38MAPK、Wnt、JAK2/STAT3和ERK1/2信号传导[15, 16]。Wnt信号通路由经典的Wnt/β -catenin信号通路和非经典的Wnt信号通路组成。研究显示Wnt/β -catenin信号通路在细胞的分化、增殖、凋亡过程中具有重要作用。 研究发现AS-Ⅳ 通过Wnt/β -catenin信号传导通路改善大鼠急性心肌梗死后心室重构[17]; AS- Ⅳ 可以通过靶向调控Wnt/β -catenin信号通路来保护过氧化氢诱导的人脐静脉内皮细胞损伤[18]; 同时AS-Ⅳ 通过Wnt/β -catenin途径影响HepG-2细胞的增殖和凋亡[19]。在本研究中, Wnt/β -catenin信号通路激活剂明显减弱了缺氧条件下AS-Ⅳ 处理对低氧PASMCs增殖和迁移的影响。而且, 结果表明AS-Ⅳ 至少部分地通过调节Wnt/β -catenin信号转导改善了低氧诱导的肺动脉平滑肌细胞的增殖和迁移。
本研究也存在一定的局限性。对于Wnt/β -catenin信号的探讨仅在初步阶段, 有必要对Wnt/β -catenin信号通路进行深入的研究探索; 试验仅使用人PASMCs来进行研究, 需进一步使用大鼠肺动脉高压模型进行体内验证。本研究探索了AS-Ⅳ 与Wnt/β -catenin信号通路之间的相互作用, 而其他可能影响的信号通路也应进行相关研究。
研究表明AS-Ⅳ 能够逆转低氧引起的PASMCs的增殖和迁移, 此作用机制可能是通过调控Wnt/β -catenin信号通路实现的, 为AS-Ⅳ 成为治疗肺动脉高压潜在药物提供新的实验基础。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|