作者简介:周辉芳(1980—),女,博士,主治医师,研究方向:感染性疾病的诊断与治疗。
目的 采用网络药理学和分子对接的方法探讨血必净注射液治疗新型冠状病毒肺炎(COVID-19)的潜在调控机制。方法 借助中药系统药理学数据库与分析平台(TCMSP)获得血必净注射液所有有效活性成分的干预靶点,并与GeneCards数据库、OMIM数据库、PharmGkb数据库、TTD数据库和DrugBank数据库中COVID-19基因相关靶标使用R编程语言取交集,从而获得血必净注射液治疗COVID-19的核心靶标;利用Cytoscape 3.7.2软件构建中药-化合物-靶标网络;通过STRING得到交集靶标的PPI网络;运用数据包进行基因本体论(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析,预测重叠靶点的作用机制。最后,应用分子对接技术,将关键有效活性成分和PPI中核心蛋白进行分子对接。结果 GO功能富集分析包括1 818个生物过程(biological process, BP),20种细胞组分(cellular component, CC)以及89种分子功能(molecular function, MF)。前30条KEGG相关通路涉及炎症和免疫反应等,如类风湿性关节炎信号通路、IL-17信号通路、Th17细胞分化通路、缺氧诱导因子(HIF)-1信号通路、JAK-STAT信号通路、炎症性肠病信号通路、NF-κB信号通路等。槲皮素、隐丹参酮、木犀草素、β胡萝卜素可影响IL1B、STAT3、AKT1、VEGFA等重叠靶点,同时,槲皮素可能通过IL1B结合,发挥抗炎、抗病毒和免疫应答作用,治疗COVID-19。结论 本研究揭示了血必净注射液中的化学成分通过与关键靶蛋白结合涉及多种生物学过程及通路治疗COVID-19。
Objective To explore the potential regulatory mechanism of Xuebijing injection in the treatment of COVID-19 by using network pharmacology and molecular docking methods.Methods Corresponding target genes of all the active ingredients of Xuebijing injection were obtained by using the pharmacological database and analysis platform of TCM System (TCMSP). And intersections with the COVID-19 gene-related targets in GeneCards database, OMIM database, PharmGkb database, TTD database and DrugBank database using the R programming language. Thus, the core target of Xubijing injection in COVID-19 treatment was obtained; Cytoscape 3.7.2 software was used to construct TCM - compound - target network; PPI network of intersection target was obtained by STRING; Utilized data packets to perform gene ontology (GO) functional enrichment analysis and Kyoto Encyclopedia of Genes and Genomes (KEGG) pathway enrichment analysis to predict the mechanism of overlapping targets. Finally, molecular docking technology was implemented to dock key active ingredients with PPI core protein.Results GO functional enrichment analysis included 1 818 biological processes (BP), 20 cellular components (CC) and 89 molecular functions (MF). The first 30 KEGG related pathways involved inflammation and immune response, such as rheumatoid arthritis signaling pathway, IL-17 signaling pathway, Th17 cell differentiation pathway, hypoxia-inducible factor (HIF-1) signaling pathway, JAK-Stat signaling pathway, inflammatory bowel disease signaling pathway, NF-κB signaling pathway, etc. Quercetin, cryptotanshinone, luteolin, β -carotene can affect IL1B, STAT3, AKT1, VEGFA and other overlapping targets. Meanwhile, quercetin may exert anti-inflammatory, antiviral and immune responses through IL1B binding to treat COVID-19.Conclusion This study reveals that chemical components in Xuebijing injection are involved in multiple biological processes and pathways in COVID-19 treatment through binding to key target proteins.
新型冠状病毒肺炎(COVID-19)是由新型冠状病毒(SARS-CoV-2)感染引起的疾病[1]。由于人群对新型冠状病毒普遍易感, COVID-19给全球公共卫生构成持续和严重的威胁。根据世界卫生组织的数据, 截至2022年5月20日, 全球报告的COVID-19确诊病例超过5.21亿例, 死亡病例超过627万例[2]。目前, COVID-19相关特效药物仍然缺乏。
血必净注射液由古方“ 血府逐瘀汤” 精制而成, 由红花、赤芍、川芎、当归、丹参5种中药组成, 已被国家食品药品监督管理总局批准上市, 临床多用于治疗全身炎症反应综合征、多器官功能障碍综合征、脓毒症等危重疾病[3]。研究结果表明, 血必净注射液可以上调toll相互作用蛋白(Tollip)的表达, 阻断白细胞介素-1受体相关激酶1 (IRAK1)、toll样受体4(TLR4)、核因子-κ B65(NF-κ B65)和TNF受体相关因子6 (TRAF6)的活性, 对脓毒症大鼠肺通透性渗漏及肺损伤具有保护作用[4]。相关研究表明血必净注射液具有显著的抗炎作用[5, 6, 7]。
在2022年3月15日正式发布的《新型冠状病毒肺炎诊疗方案(试行第九版)》中重申了中医中药在治疗新型冠状病毒感染的重要性和有效性[8]。该方案中, 血必净注射液被列为重症、危重症的治疗措施之一, 建议在患者出现重型的气血两燔证和危重型的内闭外脱证时使用。刘学松等[9]采用多中心前瞻性队列研究设计, 对144例COVID-19重症患者的治疗进行分析, 发现联合血必净注射液能够明显改善重症COVID-19患者的临床预后。血必净注射液对新冠肺炎具有积极的治疗作用, 但其潜在作用机制尚不明确。
网络药理学是以系统理论为基础的生物学。构建药物、靶标、通路、疾病的相互作用网络, 通过筛选关键节点, 分析其内在关联。中药具有多个组分和靶标的优点, 这与网络药理学的方法学相对应[10]。
本研究以网络药理学为基础, 首先筛选血必净注射液的活性成分, 明确其治疗COVID-19的靶点和通路。此外, 利用分子对接方法预测药理活性化合物与COVID-19潜在治疗靶蛋白的亲和力。这为深入探讨血必净注射液治疗COVID-19的药理作用机制提供理论依据。
借助中药系统药理学数据库与分析平台(TCMSP, http://tcmspw.com/tcmsp.php), 检索血必净注射液中所含红花、赤芍、川芎、当归、丹参5种中药的有效活性成分和中药靶标, 以系统药理学方法来分析传统中医药时, 以口服生物利用度(OB)≥ 30和类药性(DL)≥ 0.18为筛选生物活性成分的标准[11]。应用Uniprot(https://www.uniprot.org)数据库和处理文本文件的perl语言将中药靶标统一为标准基因名。由此形成了血必净注射液有效活性成分的目标数据库。
为了构建网络, 我们收集了与COVID-19疾病相关的靶基因。COVID-19的潜在靶标来自5个资源:GeneCards数据库(https://www.genecards.org/)、OMIM数据库(https://omim.org/)、PharmGkb数据库(http://www.pharmgkb.org/)、TTD数据库(http://db.idrblab.net/ttd/)和DrugBank数据库(https://www.drugbank.ca/)。删除重复基因后即为COVID-19的目标数据库。最后将血必净注射液主要活性成分的靶标与COVID-19相关靶标使用R语言4.1.2程序(bioconductor等数据包)取交集并绘制韦恩图, 从而获得血必净注射液治疗COVID-19的核心靶标。
将中药名称、化合物名称、核心靶标名称导入Cytoscape 3.7.2软件, 构建中药-化合物-靶标网络。此外, 还应用了“ network analyzer” 插件计算节点的“ degree” 度。一般认为, “ degree” 高的节点可能是有意义的化合物或靶点, 在整个生物网络中起着关键作用。
将化合物和疾病的重叠靶基因输入STRING数据库(https://string-db.org/), 分析靶蛋白之间的PPI。将有机体设为“ Homo sapiens” , 赋值(置信度)> 0.4。为了确定血必净注射液治疗COVID-19的核心靶点, 将获得的PPI网络数据导入Cytoscape 3.7.2软件进行进一步分析。应用 “ CytoNCA” 插件计算节点分值, 打分高的节点再构建新网络, 最终筛选出核心蛋白。
为了更深入地了解所获得的核心靶基因的功能及其在信号通路中的作用, 利用R语言4.1.2程序基于bioconductor、Pathview等数据包提取信息, 得到交集靶标的基因本体论(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析, 以P< 0.05为差异有统计学意义。
通过将已知三维结构的配体化合物(即药物成分)置于受体蛋白(中药靶点)的活性位点处, 利用特定的构想搜索策略改变配体取向、位置以及构象, 以寻找配体和受体的最佳结合状态。首先, 从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)下载活性化合物对应的2D结构* sdf文件。活性化合物利用ChemOffice软件绘制3D结构并使其能量最小, 保存成* mol2格式。通过 PDB 数据库(http://www.rcsb.org/)下载蛋白受体的 3D 结构 * PDB 格式。利用Pymol 软件对受体进行去溶剂、去水等操作。然后, 配体和受体利用Auto Dock Tools软件对受体进行加氢和加电子, 并保存成* pdbqt格式。最后, 运行Vina对接, 根据活性化合物的最优结合能进行排序。
利用TCMSP平台, 血必净注射液共有125个有效活性成分纳入本次研究, 其中红花22个、赤芍29个、川芎7个、当归2个、丹参65个, 对这些成分进行靶点预测, 共获得225个与血必净注射液相关的靶点。
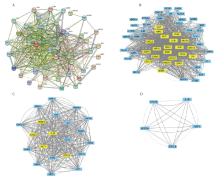
检索GeneCards、OMIM、PharmGkb、TTD和DrugBank数据库, 去除重复数据后, 获得1 490个与COVID-19相关的靶点(图1A)。其中, 血必净注射液与COVID-19共有53个重合靶点(图1B), 这成为我们后续分析的重点。
“ 中药-化合物-靶标” 网络由共有116个节点和225个边界。这些相互作用表明, 一个化合物可以调制多个靶标, 而一个靶标可以同时被多个化合物调节。根据网络节点的节点度参数, 网络中排名前5位的化合物分别为槲皮素(quercetin, MOL000098)、木犀草素(luteolin, MOL000006)、山奈酚(kaempferol, MOL000422)、黄芩素(baicalein, MOL002714)和β 胡萝卜素(β -carotene, MOL00277 3), 可分别与40、17、15、10、8个靶点相互作用。从靶标来看, 排名前5位的分别是DPP4、ADRA1A、AR、ESR1和SLC6A4, 分别可以与28、27、25、24和10种化合物相互作用。
PPI网络共有53个节点, 1 040个交互关系(图2)。经过进一步分析, 最终过滤出5个核心靶标。结合Cytoscape 3.7.2中药-复合物-靶标结果, 提示IL1B、STAT3、AKT1、VEGFA和CXCL8等基因可能在COVID-19的治疗中发挥重要作用。
GO功能富集分析得到1 927个结果(P< 0.05), 其中生物过程(BP)结果 1 818个, 细胞组成(CC)结果20个, 分子功能(MF)结果89个, 分别占94%、1%和5%。最重要的GO富集通路包括凋亡信号通路、炎症反应、氧化应激反应等信号通路。通过KEGG富集结果筛选出134条通路(P< 0.05)。根据P值筛选KEGG结果前30名和GO注释分析中生物过程(BP)、细胞组分(CC)、分子功能(MF )结果前10名, 用R软件包分别可视化(图3)。
从图3可见, 与炎症和免疫反应相关的多种信号通路显著富集, 如类风湿性关节炎信号通路、IL-17信号通路、Th17细胞分化通路等等。调控病毒感染相关通路的富集水平也不容忽视。这些通路涉及人类巨细胞病毒感染、甲型流感、卡波西肉瘤相关疱疹病毒感染相关通路。此外, 在癌症途径、动脉粥样硬化相关信号通路和其他传染性肺部疾病如肺结核、麻疹中也表现出一定程度的富集。因此, 我们推测血必净注射液可能通过调节炎症和免疫相关通路、病毒感染相关通路而对COVID-19治疗有益。
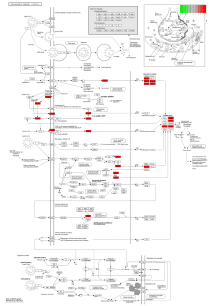
进一步利用R语言4.1.2程序基于Pathview数据包提取信息, 绘制与“ COVID-19” 疾病的通路图(图4)。提示特别是IL1B在COVID-19的致病过程中发挥重要作用。从网络上可以看出, COVID-19的靶标是多路径协调控制的。
基于以上结果分析, 网络中排名前5位的化合物分别为槲皮素、木犀草素、山奈酚、黄芩素和β 胡萝卜素, 即关键有效活性成分, IL1B、STAT3、AKT1、VEGFA和CXCL8为PPI核心网络中的关键蛋白, 且IL1B在COVID-19致病过程中可能发挥重要作用, 故选择槲皮素和IL1B两者分别作为分子对接的配体和受体(图5)。
 | 图5 关键化合物槲皮素与核心蛋白IL1B分子对接Fig. 5 The key compound quercetin performs molecular docking with the core protein IL1B |
分子对接结果表明, 槲皮素与IL1B的结合自由能为-7.9, 说明关键化合物与核心蛋白的结合构象能量低, 结构稳定。
在新冠肺炎的治疗中, 中医药发挥了不可忽视的作用[12]。据报道, 血必净治疗COVID-19普通型可以促进肺部感染病灶吸收并提高疗效, 安全性良好[13]。血必净注射液是危重症的治疗措施之一。大量证据表明血必净注射液具有明显的抗炎作用。血必净注射液可降低血清中IL-6、TNF-α 、MCP-1、MIP-2、IL-10等多种炎症介质的过度生成, 以及Pam3CSK4启动的炎症反应和信号通路的过度激活[14]。在中国, 每年约有80万名患者接受血必净注射液治疗, 其中约80% 为脓毒症或脓毒休克病例[15]。新型冠状病毒肺炎的病理生理学包括直接的病毒细胞病变效应, 同时也包括过度的炎症反应 (所谓的“ 细胞因子风暴” )[16]。因此, 血必净注射液可能通过调节炎症和免疫反应治疗COVID-19。血必净注射液的5种中药成分(红花、赤芍、川芎、当归、丹参)中, 红花的主要成分有槲皮素、β 胡萝卜素、山奈酚等。藏红花素具有强大的抗氧化作用, 能够减轻急性肺损伤时细胞因子风暴的产生, 能够下调NF-κ B的表达, 从而产生广泛的免疫调节和抗炎作用, 同时激活Nrf2通路, 减轻病毒诱导的氧化应激[17]。赤芍的主要成分为芍药苷、丹皮酚、鞣花酸、黄芩素等。其中鞣花酸和功能化氧化锌组成的纳米结构对DNA和RNA病毒具有灭活作用[18]。丹参成分有隐丹参酮、木犀草素, 其中可吸入的隐丹参酮喷雾干燥可膨胀微颗粒通过调节TGF-β 1/Smad3、STAT3和SIRT3通路治疗肺纤维化[19], 而木犀草素可能是SARS-CoV-2进入细胞的强效阻滞剂[20]。川芎中的川芎多糖是一种具有抗氧化、促进免疫、抗肿瘤、抗菌等多种活性的有效物质[21]。综上所述, 血必净注射液可通过多种成分协同发挥抗炎作用, 对肺部炎性疾病有显著影响。
根据网络分析结果, IL1B、STAT3、AKT1、VEGFA和CXCL8是槲皮素、隐丹参酮、木犀草素、β 胡萝卜素、鞣花酸等成分的共同靶点, 可能是血必净注射液治疗COVID-19的关键。已知IL1B与大量受体及其拮抗剂以及辅助蛋白结合, 从而调节先天免疫和炎症, IL1B通路调节ERK1/2、MAPK和NF-κ B触发细胞信号通路级联[22]。STAT3是一种重要的转录因子, 呼吸综合征病毒通过诱导STAT3的降解来拮抗IL6激活的JAK-STAT3信号, 说明STAT3在调节病毒诱导的促炎反应中发挥保护作用[23]。AKT1是胰岛素激活通路上的关键节点, 是强效抗氧化剂[24], AKT1高度参与血管内皮生长因子(VEGF)介导的血管通透性, 因为在VEGF刺激的内皮细胞中AKT1的磷酸化显著增加[25]。而缺氧是VEGFA表达的最有效的触发因素之一, 其作用于VEGFA DNA转录、VEGFA mRNA稳定以及VEGFA翻译和释放[26]。VEGFA是HIF-1的下游靶标, 缺氧产生的血管生成通常呈VEGFA依赖性[27]。CXCL8, 也称为IL-8, 属于CXC趋化因子家族, 是一种有效的中性粒细胞趋化因子, 是中性粒细胞依赖性炎症的关键介质[28]。CXCL8在免疫监视、炎症和血管生成中具有多种功能[29]。与星形胶质细胞CXCL8调控相关的细胞内信号通路, 如PKR和MAPKs, 包括p38、JNK和ERK1/2, 均参与了星形胶质细胞CXCL8的诱导[30]。CXCL8还可增加MMP-2的表达[31]。KEGG富集结果显示与炎症和免疫反应相关的多种信号通路显著富集。IL1B、STAT3、AKT1、VEGFA可向以下途径富集:NF-κ B信号通路、JAK-STAT信号通路、PI3K-AKT信号通路、HIF-1信号等通路, 提示血必净注射液可能通过槲皮素、隐丹参酮、木犀草素、β 胡萝卜素作用于IL1B、STAT3、AKT1、VEGFA, 进而影响炎症、免疫调节、以及病毒感染相关途径, 发挥了抗炎治疗新冠肺炎的作用。
在分子对接过程中, 我们选择关键有效活性成分槲皮素和关键蛋白IL1B两者分别作为分子对接的配体和受体, 结合能为负值, 提示模型对接效果好且稳定性强, 表明血必净注射液的可能通过IL1B等靶蛋白干预COVID-19疾病进程, 促进机体修复。
然而, 本研究基于网络药理学及分子对接技术探讨血必净注射液治疗COVID-19的潜在药效成分及机制进行探索, 以期为临床应用提供依据, 但对预测成分、核心靶标和通路缺乏深入的研究。因此, 需要进一步的研究和相关的体内外验证。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|