作者简介:郭珊珊(1986—),女,本科,主治医师,研究方向:耐药结核病。
目的 分析抗结核治疗前后敏感肺结核与耐药肺结核患者的细胞因子水平的变化。方法 收集2019年8月—2020年10月新疆医科大学第八附属医院收治的213例肺结核患者的临床资料,分为敏感肺结核组和耐药肺结核组,其中敏感组141例,耐药组72例,比较治疗前、治疗3个月及6个月血浆中促炎因子肿瘤坏死因子-α(TNF-α)、IL-6、IL-17、干扰素-γ(IFN-γ)及抗炎因子IL-10、IL-4的含量变化情况。结果 与健康组相比,敏感组及耐药组血浆IL-6含量升高明显,差异有统计学意义( P<0.01),敏感组血浆IFN-γ、IL-17含量升高,差异有统计学意义( P<0.05)。与治疗前相比,敏感组治疗6个月比治疗3个月血浆中IL-6、IL-4含量降低,差异有统计学意义( P<0.05),IFN-γ降低明显( P<0.001);治疗6个月比治疗前IL-10含量降低,差异有统计学意义( P<0.05),IFN-γ降低明显( P<0.000 1);耐药组均无明显变化;敏感组治疗前及治疗3个月IFN-γ均高于耐药组,差异有统计学意义( P<0.01),治疗6个月后敏感组、耐药组IFN-γ含量差异无统计学意义。CT吸收有效率在治疗3个月时敏感组为70%,耐药组仅为43.33%,而治疗6个月后两组有效率无明显差异。结论 检测血浆中促炎细胞因子及抗炎细胞因子的含量,能够对肺结核的宿主导向治疗提供参考。了解细胞因子对病原体–宿主相互作用这一重要特性可以为毒力机制研究提供新的视角,并且可为肺结核提供新的免疫干预方法。
Objective To analyze the changes of cytokine levels in patients with sensitive pulmonary tuberculosis and drug-resistant pulmonary tuberculosis before and after anti-tuberculosis treatment.Methods The clinical data of 213 pulmonary tuberculosis patients admitted to the Eighth Affiliated Hospital of Xinjiang Medical University from August 2019 to October 2020 were collected, and divided into a sensitive pulmonary tuberculosis group and a drug-resistant pulmonary tuberculosis group, of which 141 were in the sensitive group and 72 in the drug-resistant group , and the pro-inflammatory factors tumor necrosis factor-α (TNF-α), IL-6, IL-17, interferon-γ (IFN-γ) and anti-inflammatory factors IL-10 and IL-4 in plasma before treatment, 3 months and 6 months after treatment were compared.Results Compared with the healthy group, the levels of plasma IL-6 in the sensitive group and the resistant group were significantly increased, difference was statistically significant ( P<0.01). The plasma levels of IFN-γ and IL-17 in the sensitive group were increased, and the difference was statistically significant ( P<0.05). Compared with before treatment, the levels of IL-6 and IL-4 in the plasma of the sensitive group after 6 months of treatment were lower than those after 3 months of treatment, and the difference was statistically significant ( P<0.05), and IFN-γ was significantly decreased ( P<0.001). After 6 months of treatment, the IL-10 content was lower than that before treatment, and the difference was statistically significant ( P<0.05), and the IFN-γ decreased significantly ( P<0.000 1). The levels of IFN-γ at 3 months were higher than those in the resistant group, and the difference was statistically significant ( P<0.01). After 6 months of treatment, there was no significant difference in the content of IFN-γ between the sensitive group and the resistant group. The effective rate of CT absorption was 70% in the sensitive group and only 43.33% in the resistant group at 3 months of treatment, and there was no significant difference in the effective rate between the two groups after 6 months of treatment.Conclusions Detection of pro-inflammatory cytokines and anti-inflammatory cytokines in plasma can provide reference for host-directed therapy of pulmonary tuberculosis. Understanding this important feature of cytokines on pathogen-host interactions can provide new insights into the study of virulence mechanisms and may provide new approaches for immune intervention in pulmonary tuberculosis.
肺结核是全球重大公共卫生问题之一, 据WHO报告, 2020年全球新发结核病患者约987万, 128万人死亡。中国的新发患者排世界第二位[1]。感染结核杆菌后, 机体并不立即发病, 当机体免疫功能下降或出现炎症细胞因子介导的变态反应增强时才会发病, 即活动性肺结核[2]。目前, 还不清楚耐药结核病是否表现出与敏感结核病不同的炎症特征, 同样重要的是, 这种特征是否随着抗结核治疗而改变[3]。结核分枝杆菌感染引起的肺结核病发病机制尚未完全阐明, 主流理论认为结核病是以 T 细胞介导的细胞免疫为主, 而淋巴细胞分泌的炎症因子, 在结核免疫进程中扮演着重要角色[4]。深入探讨肺结核患者炎症因子的水平可能对于结核病的预防和诊治有着重要意义。因此, 本研究收集医院收治的活动性肺结核患者的临床资料, 探究患者血浆促炎及抗炎因子动态变化趋势, 现汇报如下。
2019年8月— 2020年10月新疆医科大学第八附属医院主院区收治的213例肺结核患者的临床资料, 分为敏感组和耐药组, 其中敏感组141例, 男59例, 女82例, 年龄范围18~80岁, 平均年龄(47.71± 20.32)岁; 耐药组72例, 男42例, 女30例, 年龄范围18~86岁, 平均年龄(47.24± 21.26)岁。两组一般资料比较差异无统计学意义。本研究符合《赫尔辛基宣言》医学研究的伦理原则。
纳入标准:①根据中华人民共和国卫生行业标准WS 288-2017《肺结核诊断》诊断标准确诊为肺结核者[5]。②痰液或气管镜灌洗液涂片抗酸杆菌阳性或分子生物学检测或结核菌培养检测至少1种检测方法阳性。③所有患者均进行痰液或气管镜灌洗液分子生物学检测或结核菌培养进行耐药基因或药敏检测明确耐药性, 对所有抗结核药物敏感的为敏感组, 至少检测2次对1种及以上结核药物耐药的纳入耐药组。④年龄≥ 18岁。排除标准:①合并局部及全身感染。②合并HIV、乙肝病毒、丙肝病毒等感染。③合并其他呼吸道疾病, 如慢性支气管炎、慢性阻塞性肺疾病及哮喘等。④合并自身免疫性疾病。⑤合并恶性肿瘤等疾病。⑥非结核分枝杆菌病。⑦孕妇及哺乳期妇女。⑧没有结核病呼吸道症状的受试者及没有结核接触史且结核菌素皮肤试验呈阴性者。
1.2.1 治疗方法 按照《中国结核病防治规划实施工作指南》[6]中的相关推荐, 对患者进行抗结核化学药物治疗。同时按照耐药结核病化学治疗指南(2019年简版)[7]中的相关推荐, 对耐多药及利福平耐药结核患者进行抗结核化学药物治疗。
1.2.2 实验室检测 健康组、敏感组及耐药组患者在基线(治疗前), 敏感组及耐药组在治疗3个月后和 6个月后, 分别晨起空腹抽取静脉血4 mL, 4 000 r/min离心10 min, 离心半径21 cm, 吸取上层血浆, 保存于 -80 ℃冰箱。采用流式细胞检测技术, 试剂盒(青岛瑞斯凯尔生物科技有限公司), 测定两组患者以上时间点血浆中促炎因子肿瘤坏死因子-α (TNF-α )、 IL-6、IL-17、干扰素-γ (IFN-γ )及抗炎因子IL-10、IL-4的含量, 所有操作均按照试剂说明书进行。
1.2.2.1 试剂准备 使用之前将所有的试剂自然恢复至室温待用。(1)微球准备:实验前先将微球涡旋30 s。(2)洗涤缓冲液配制:将10× 洗涤缓冲液恢复至室温, 待所有盐溶解, 用去离子水稀释至1× 待用。(配置好的洗涤缓冲液可在冰箱冷藏保存1周)。
1.2.2.2 样本准备 样本:血浆(溶血、脂血、黄疸血样本不建议使用)。离心条件:取血后4 h内, 至少 1 000× g离心10 min。检测时间:首要建议按要求离心后当天立即检测; 隔天24 h内检测, 需将血浆分离分装到EP管中, 2~8 ℃保存; 72 h内检测, 需将血浆分离分装到EP管中, -20 ℃或-80 ℃保存; 若分离分装保存样本, 恢复室温时使用。
1.2.2.3 实验步骤 (1)向流式管中加入25 μ L 实验缓冲液; (2)向流式管中加入25 μ L捕获微球抗体; (3)向流式管中加入25 μ L样品(血浆); (4)向流式管中加入25 μ L检测抗体; (5)室温(25± 1 ℃)避光震荡孵育2 h(400~500 r/min); (6)向样本管中加入25 μ L SA-PE; (7)室温(25± 1) ℃避光震荡孵育0.5 h(400~ 500 r/min); (8)向每管中加入500 μ L 1× 洗涤缓冲液, 涡旋数秒, 500× g 离心5 min, 缓慢倾倒出液体, 倒扣于吸水纸上; (9)根据流式细胞仪上样需求, 向每管中加入100 μ L稀释好的洗涤缓冲液; (10)涡旋10 s将微球重悬, 立即上机检测。
采用SPSS 25.0统计分析软件对本研究所有数据进行处理和研究, GraphPad Prism 8.0.2绘图软件进行绘图, 计量资料采用x± s(正态分布)或四分位数(非正态分布)的形式表示; 若符合正态分布则采用t检验, 组内比较行配对t检验, 组间比较行成组t检验; 多组间比较采用重复测量方差分析; 以P< 0.05为差异有统计学意义。
住院肺结核患者1 628例, 排除不符合条件及不愿入组患者1 415例, 最后收集符合条件的患者213例, 其中耐药组72例, 敏感组141例, 按国家标准化方案抗结核治疗3个月后耐药组死亡2例、失访10例, 敏感组失访11例, 抗结核治疗6个月后耐药组死亡1例、失访18例, 敏感组失访62例。
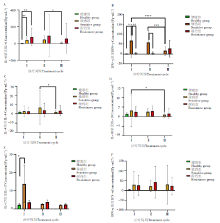
与健康组相比, 治疗前敏感组及耐药组血浆IL-6含量升高明显(P< 0.01), 敏感组血浆IFN-γ 、IL-17含量升高(P< 0.05); 与治疗前相比, 敏感组治疗6个月比治疗3个月后血浆IL-6、IL-4含量降低(P< 0.05), IFN-γ 降低明显(P< 0.001); 治疗6个月比治疗前IL-10含量降低(P< 0.05), IFN-γ 降低明显(P< 0.000 1), 耐药组治疗前后均无显著性变化; 敏感组治疗前及治疗3个月IFN-γ 均显著高于耐药组(P< 0.01), 治疗6个月后无显著差异。见图1。
对两组患者采用胸部CT检测比较两组患者治疗3个月、6个月的肺部病灶吸收情况, 分别在治疗3个月和6个月后进行影像学胸部CT检查, 以所有病灶相加后所占的肺野数计算, 依据2009年中华医学会《临床诊疗指南:结核病分册》[8]制定的相关标准进行评价, 其中病灶吸收≥ 原病灶的 1/2, 空洞闭合或缩小1/2或以上为显著吸收; 病灶吸收< 原病灶的1/2, 空洞缩小不足1/2为吸收; 病灶无明显改变, 空洞基本无变化为不变; 病灶变大或播散, 空洞直径增大1/2为恶化。吸收率=(显著吸收+吸收)例数/总例数× 100%, 结果如表1。
| 表1 两组胸部CT吸收情况比较 Table 1 Comparison of chest CT absorption between the two groups |
研究得出, 与抗结核治疗前相比, 敏感组治疗6个月后比治疗3个月后血浆中IL-6、IL-4、IFN-γ 显著降低; 治疗6个月后比治疗前IL-10、IFN-γ 含量显著降低, 在耐药组不同的治疗时间段的平均细胞因子水平几乎保持不变, 表明抗炎细胞因子反应抑制了促炎反应, 这可能是由于促炎和抗炎反应之间的失衡所致。我们的数据支持了这样一种假设, 即敏感结核和耐药结核之间的免疫反应是不同的, 并且可能宿主的遗传正在发挥重要作用[3]。治疗前后耐药组患者的细胞因子均无显著变化, 而IL-6对比健康人始终处于高水平, 这表明即使抗结核治疗, 耐药肺结核患者也不太能激活炎症的调节机制。值得注意的是, 我们在治疗结束时发现了持续高水平的IFN-γ , 特别是在耐药结核病患者的血浆中。而敏感组在治疗结束时INF-γ 水平明显降低, 这与墨西哥的一项研究结果相似[3]。敏感组患者治疗前及治疗3个月IFN-γ 均高于耐药组, 治疗6个月后差异无统计学意义。由于患者入组时部分仅分子生物学检测阳性, 无法统一评价患者在治疗3个月及6个月的痰菌阴转情况。因此我们用胸部CT吸收情况评价了治疗的有效性。在治疗有效率方面, 治疗3个月时敏感组为70%, 耐药组仅为43.33%, 而治疗6个月后两组有效率差异无统计学意义, 目前的数据表明, 耐药结核患者对分枝杆菌抗原的整体免疫应答降低, 炎性细胞因子可能在持续肺组织损伤中起主要作用[9]。
近年来发现, 肺结核感染结核分枝杆菌系慢性、持续性免疫应答过程[2], CD4+T细胞、IFN-γ 等细胞因子在适应性免疫应答中有关键作用, 可启动机体免疫防御体系, 并决定抗结核疗效[10]。在抗结核治疗后, IFN-γ 的表达水平下降, 这与印度海德巴拉的一项研究结果相似[11]。研究发现IL-6、TNF-α 等炎症细胞在肺结核发病时水平升高[12], 与本文的研究相似, 但可能因样本量小, TNF-α 没有表现出明显的差异。
我们在结核病患者外周血中发现的IL-4升高与其他报告一致[13– 16]。使用IL-4作为结核病进展或治疗反应的生物标志物可能有一些诊断用途, 但需要大量的验证研究[17]。IL-4破坏了抗分枝杆菌的杀菌机制, 破坏了受感染的单核细胞来源的巨噬细胞对结核分枝杆菌的抑制作用[18]。在耐药结核参与者中也观察到类似的分枝杆菌遏制减少, 但这没有达到统计学显著性, 可能是因为本研究中样本数量较少。
IL-10是一种由先天和适应性免疫细胞产生的免疫调节细胞因子, 结核分枝杆菌通过模式识别受体信号直接刺激单核细胞、巨噬细胞、树突状细胞和中性粒细胞产生IL-10[19]。IL-10的产生增加可能是由于活动性肺结核患者的原始细胞反应和IFN-γ 产生减少所致。本文中经抗结核治疗后敏感肺结核组抗炎因子IL-4、IL-10均较前有显著下降, 这与程永宏等[20]报道的结果不一致。
相关研究表明, IL-6能促进IFN-γ 的产生, 增强T细胞和自然杀伤细胞的杀伤活性, 抑制结核分枝杆菌的生长[21]。IL-6细胞因子基因的单核苷酸多态性与许多感染性疾病的易感性、严重程度和临床转归有关[22]。确定与结核病易感性和耐药性有关的宿主基因可能有助于更好地理解结核病的发病机制和制定预防或治疗策略[23]。
综上所述, 促炎细胞因子基因表达与抗结核保护性免疫相关, 但感染后水平较高是活动性肺结核的危险因素。因此, 我们的数据表明, 控制结核分枝杆菌感染过程中过度炎症反应的机制可能在结核的免疫病理中起着关键作用[11]。
随机对照试验, 除非是长期的, 否则可能没有足够的随访来捕获所有的病例, 因此, 对于耐药组细胞因子的研究未发现有显著差异可能也与随访时间不足有关。本研究有两个局限性:一是参与研究的个体数量有限, 数据源于新疆地区的一家医院, 且因地域及经济因素的制约, 地州患者的脱落数据较多, 代表性不足[24]。二是大部分患者尤其是老年人无法确认是否在出生时接种了卡介苗, 可能无法评估卡介苗对细胞因子的影响。细胞因子在肺结核患者中发挥着重要的作用, 其动态变化可以有效地显示患者免疫功能及患者病情的严重程度, 对于判断和了解肺结核患者病情的变化以及评估其预后有着重要的价值。但进一步的细胞免疫分型、激活效应机制等尚未十分明确, 值得临床、基础进一步探究。
利益冲突声明 所有作者声明不存在利益冲突
编辑:陈景丽 谢永慧
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|