作者简介:杨俊杰(2001—),男,本科在读,研究方向:临床医学。
当前常用基于PCR原理的核酸检测技术来检测疟原虫,疟原虫检测方法主要包括镜检法、抗原免疫检测法和核酸检测法等。但由于存在检测时间长、人员和设备要求高等缺点,限制了其在基层的推广应用。特别是基层普遍缺乏经验丰富的专业技术人员和高端仪器设备,此外在极端环境下快速检测大规模样品的需求等对现存疟原虫检测方法造成了挑战。近年来发展起来的等温扩增技术由于具有简便、快速、灵敏性和特异性高等优点,具有潜在的应用前景。本综述介绍了试对各类等温扩增技术的原理、特点和前景等,并在此基础上重点综述重组酶聚合酶扩增技术(recombinase polymerase amplification, RPA)与重组酶介导的等温扩增技术(recombinase-aided isothermal amplification assay, RAA),并提出利用这类重组酶扩增技术,实现常见疟原虫种快速、精确诊断的可能。
At present, nucleic acid detection technology based on the PCR principle is commonly used to detect malaria parasites, the existing Plasmodium detection methods mainly include microscopy, antigen immunoassay, and nucleic acid detection,but due to the long detection time, high personnel and equipment requirements, and other shortcomings, its popularization, and application at the grassroots level are limited. What challenges previous Plasmodium detection methods are the lack of experienced professionals and advanced equipment at the grassroots as well as the requirement of rapid detection of large samples under extreme conditions. The isothermal amplification technology developed in recent years has potential application prospects due to its simplicity, rapidity, high sensitivity, and high specificity. This article attempts to review the principles, characteristics, and prospects of various isothermal amplification technologies, and on this basis, focuses on the introduction of recombinase polymerase amplification (RPA) and recombinase-aided isothermal amplification (RAA) assay technologies and proposes the use of such recombinant enzyme amplification technologies to achieve rapid and accurate diagnosis of common Plasmodium species possibility and imagination.
目前, 疟原虫诊断主要依靠镜检法、抗原免疫检测法和核酸检测法等方法。WHO更是将镜检法作为疟疾诊断方法的“ 金标准” , 然而在实际工作中镜检法不可避免有其局限性:其一, 在大规模的疟疾流行病学调查时, 镜检法耗时、耗力, 需要大量经验丰富的专业人员; 其二, 对于低原虫血密度或混合感染这类复杂的疟疾样本, 镜检准确率难以保证。而抗原免疫检测法具有便携性、普适性和高特异性和灵敏性等优点, 但也存在准确率不高, 易出现假阳性, 且无法鉴别现行和既往疟疾感染等问题[1]。近年来发展起来的基于PCR原理的核酸检测法灵敏度虽高, 但其检测时间往往过长, 且对试剂、设备及环境场所要求高, 大大限制了其在基层医疗单位的应用和推广。等温扩增技术, 顾名思义, 是能在特定的恒定温度下对核酸进行快速检测的技术, 兼有反应条件简便、扩增速度快、靶点选择特异性要求低等优点, 因而是现在及未来一段时间疟原虫检测中持续发展的技术手段。
目前常用的等温技术包括链替代扩增反应(strand displacement amplification, SDA)、依赖核酸序列等温扩增(nucleic acid sequence-based amplification, NASBA)、依赖解旋酶DNA等温扩增技术(helicase-dependent isothermal DNA amplification, HDA)、环介导等温扩增技术(loop-mediated isothermal amplification, LAMP)、重组酶聚合酶扩增技术(recombinase polymerase amplification, RPA)和重组酶介导的等温扩增技术(recombinase-aided isothermal amplification assay, RAA), 其中LAMP、RPA和RAA相对成熟(表1)。
| 表1 几种常见的等温核酸扩增技术比较 Table 1 Comparison of several common isothermal nucleic acid amplification techniques |
NASBA是一种由Compton于1991年提出的可对RNA序列进行扩增的核酸等温扩增技术[2]。反应体系包括AMV逆转录酶、噬菌体T7RNA聚合酶、RNase H和一对特异性引物等。只需在扩增前对DNA进行两次加热变性, 再依原理加入相应的酶进行反应, 扩增产物仍然是RNA, 即可实现对DNA的扩增[2]。NASBA在42 ℃下即可进行扩增。由于核酸扩增反应产物为大量单链RNA, 因而其具有更高的灵敏性。同时, NASBA通过杂交检测系统可以进一步提高检测的灵敏性和特异性, 是一种适用于检测RNA序列的扩增技术[2]。但NASBA并不是完全意义上的等温扩增技术, 不能进行一步扩增; 而且酶的热稳定性差, 必须在反应过程加入; 最后, NASBA技术不能对较长的RNA片段进行扩增, 有效扩增片段长度仅为100~250 bp[3]。2021年Ju等[4]将切刻和延伸链式反应系统整合到NASBA中, 建立了一种超灵敏的NASBA, 显著提高了扩增效率。
SDA是美国学者Walker 等[5]于1992年提出的基于酶促反应的新型核酸扩增技术。其基本步骤为通过引物与DNA单链片段结合于互补的3'端, 形成的双链两端均为5'端且引物链5'端含限制性内切酶识别序列, 以dNTP为底物的DNA聚合酶延长双链的3'端并产生识别位点, 限制酶切割识别序列的未修饰链, 聚合酶在切割处延长3'端并取代原单链的互补链, 重新产生识别序列, 重复此过程并产生互补链[6]。Zhang等[7]于2017年通过邻近杂交特异性识别靶蛋白以及SDA扩增荧光DNA放大荧光信号, 实现了对凝血酶和链霉亲和素的检测, 设计了用于蛋白质检测的SDA方法。SDA与横向流动试纸条或荧光技术等结合, 可实现循环过程中的快速检测[8, 9], 但SDA反应原料成本较高且扩增速率较慢[10]。2021年Zhang等[11]开发了校准器介导的SDA方法(AMC-SDA), 扩增过程不到25 min, 无需特定的靶序列, 在10个模拟样本(5个阳性和5个阴性)中实现了100%的诊断准确性。
HDA是Vincent等[12]在2004年报道的不依赖热循环的核酸等温扩增技术。该技术思路为模拟动物体内DNA复制的过程, 无需借助昂贵的热循环仪器, 在恒温水浴锅上也可完成反应。HDA反应利用DNA解旋酶产生单链模板模拟生物体内的DNA合成, 反应温度在37 ℃左右, 反应过程简单且没有高温变性过程。适用于基层实验室对病原的快速检测。但受限于DNA解旋酶结合、延伸长度和解旋速度, HDA扩增长片段时产量显著降低[13]。
LAMP通过重复发生在模板环区的两种延伸反应在恒温下进行模板DNA扩增, 产生大量具有互补序列和交替重复结构的DNA扩增产物。两种延伸反应即模板在3'端形成的茎环结构的自身延伸和新引物与环区的结合与延伸。反应原料中包含具有链置换活性的DNA聚合酶, 以及内引物和外引物各1对, 根据DNA复制延伸产生白色的焦磷酸镁衍生物的特点, LAMP法可通过荧光或比浊法目视确认结果。浊度检测方法使用DNA合成副产物磷酸镁的浊度作为指示剂, 而荧光检测方法使用荧光螯合试剂[14]。同时还有多种可直接观察的检测LAMP法扩增产物办法, 包括琼脂糖凝胶电泳、浊度检测、反应产物颜色判断等[15]。但LAMP方法也有显而易见的缺点, 即发生假阳性的概率较高, 容易发生误检。很多研究目前正试图改进和完善LAMP 技术。例如, Vincent等[16]报道了一种简单的DNA提取方法, 即超快速提取程序(PURE, Eiken Chemical), 其可在不使用离心机的情况下产生适合LAMP反应的DNA溶液, 并使用Loopamp试剂盒检测用PURE方法从干血样品中提取的DNA, 用于疟原虫DNA检测。Reboud等[17]开发了一种纸基的微流体装置, 通过使用折纸装置与LAMP相结合来检测血液样本, 用于疟疾的DNA诊断。
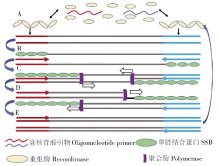
RPA作为一种新兴的体外核酸等温扩增技术, 其扩增模板序列既可以是DNA, 也可以是RNA, 主要反应原理类似T4噬菌体核酸复制。RPA反应中需要能与寡核苷酸引物结合的重组酶、单链DNA结合蛋白(single strand DNA-binding protein, SSB)、链置换DNA聚合酶以及1对引物[18]。RPA反应体系原理如图1[19]。
与PCR相比, RPA的反应温度一般为 37~39 ℃, 不需要经过高温变性、低温退火这两步, 因而反应时间更短, 只需要20~40 min, 然后通过琼脂糖凝胶电泳检测扩增产物, 因此RPA更接近于真正意义上的等温扩增[20]。RPA 反应只需要简易的恒温装置, 如水浴锅等, 甚至可以在人体体温条件下进行反应, 并不需要PCR扩增中所使用的热循环设备以及大量的电力支持。鉴于其成本低廉, 更加适合特殊条件下的快速检验。近年, 国内有团队报道了将DNA提取、多重数字RPA和荧光检测结合于一体的微流控芯片, 无需其他仪器即可快速准确检测病原体[21]。
与RPA相比, RAA是更为新型的体外等温扩增技术, 其反应原理与RPA基本相似, 但亦有不同, RAA的重组酶来源于细菌或真菌, RPA的重组酶来自T4噬茵体。在各种酶的催化作用下, 使整个反应不需要经过传统PCR的高温变性-低温退火过程, 使得整体反应时间大大缩短, 在37 ℃下反应15~30 min便可得到与传统PCR扩增相同的目的片段。同时, RAA与RPA对目标基因没有限制, 既可以扩增质粒DNA、含有质粒的菌液、动植物 DNA, 又能扩增RNA, 因而将成为未来核酸检测方面发展和大力推广的等温扩增技术[22]。
目前, 已有诸多运用等温扩增技术进行寄生虫检测的报道, 尤其是LAMP、RPA和RAA法, 取得了较好的应用效果。以LAMP法为例, Inomata等[23]基于隐孢子虫的18S rRNA建立的RT-LAMP分析方法对水体的隐孢子虫进行检测, 检测限低至6×
以RPA法为例, Sears等[27]设计了一种检测广州管圆线虫的RPA方法, 检测限低至1 fg/μ L, 并实现在人体体温条件下进行扩增。Alalremruata等[28]将等温逆转录-重组酶聚合酶扩增(RT-RPA)和侧向流动分析结合, 应用于对低密度恶性疟原虫的检测。Khan等[29]使用定量RPA方法对杜氏利什曼原虫进行检测, 表明该法在资源相对匮乏的情况下, 仍具有监测寄生虫血症的能力。
以RAA法为例, 以隐孢子虫属特异性18S rRNA核酸序列作为检测靶标所构建并优化的RAA荧光反应体系, 最低可检出的质粒浓度为102 copies/μ L[30]; 以日本血吸虫G28(SjG28)基因片段作为检测靶标建立的荧光RAA反应体系, 最低可检出的质粒浓度为 10 copies/μ L[31]; 以细粒棘球绦12S rRNA基因序列作为检测靶标所构建的细粒棘球绦虫荧光RAA检测方法, 最低可检测出0.1 ng/μ L细粒棘球绦虫基因组DNA样本和10 copies/μ L含靶序列的重组质粒DNA[32]。
相比之下, LAMP、RPA和RAA都具有较高的敏感性, 但LAMP法需要在65 ℃条件下扩增 60~80 min后, 80 ℃ 5 min终止反应, 所需温度高, 耗时较长; 而RAA只需在37 ℃ 10~20 min内即可检测完成。近几年比较热门恒温检测方法当属RPA和RAA法, 特别是后者, 已经被运用到多种寄生虫如吸虫的诊断中, 部分寄生虫的阳性检出时间、重组质粒最低检测值、DNA荧光信号最低检测值和检测分子标靶[33]见表2。
| 表2 RAA技术在寄生虫检测领域的应用 Table 2 Application of RAA technology in parasite detection |
表2中可以看出, 对于这些寄生虫来说, RAA能实现的检测时间均在10 min以内, 且检测灵敏度相对较高, 对于重组质粒来说, 最低检测值达到10~100 copies/μ L, DNA最低检测值达到0.1 fg/μ L~0.1 ng/μ L之间。因此, RAA用于寄生虫病的检测具有广阔的应用前景, 但目前尚未有RAA用于疟原虫的检测。
当前, 运用疟原虫检测的等温扩增技术仅局限在LAMP法, 尚未有RPA或RAA等方法的相关报道。例如, Han等[38]根据18S rRNA基因建立了4种人体疟原虫的LAMP检测法, 在平均26 min内完成疟原虫属检测, 在68份显微镜阳性血样中的67份(灵敏度98.5%)和53份显微镜阴性血样中的3份(特异度94.3%)中检测到疟原虫, 接近巢氏PCR结果而用时更短。王真瑜等[39]根据间日疟原虫CSP基因建立了检测间日疟原虫的 LAMP方法, 灵敏性与多重PCR法相当, 而特异性略低。Poon等[40]建立了基于疟原虫小亚基核糖体基因进行LAMP检测的方法, 灵敏度和特异度分别可以达到巢式PCR的95%和99%。
随着分子生物技术的发展, 等温核酸扩增技术发展为便携式分子诊断发展的理想候选技术。目前疟原虫分子诊断主要依靠传统的PCR技术, 但是PCR需要热循环扩增仪进行热变步骤, 造成PCR成本相对较高, 不适于现场环境下的快速检测。相比较而言, 各种等温扩增技术简便、快速、高效, 有可预见的良好应用前景。其中, 新发展的PRA与RAA技术克服了传统等温扩增技术反应时间漫长的缺陷, 也具有无需特定目标基因选择的优势。但也有不可避免的不足之处, 如在恒定温度下的扩增反应难避免的引物的非特异性结合出现的假阳性问题。尽管如此, 应用RPA和RAA技术筛选高特异性的关键酶, 将会在简便条件下的疟原虫检测方面普及应用。
苏州先达研发的酶促重组酶快速扩增技术(enzymatic recombinase amplification, ERA技术), 利用抗体制药领域的先进技术手段, 将来源于细菌、病毒和噬菌体的特定工具酶进行改造突变并筛选其功能, 通过不同的DNA扩增反应体系进行优化组合, 从而获得核心的重组等温扩增体系, 研发出具有自主知识产权的酶促重组酶快速扩增方法, 该方法在低温条件下(25~42 ℃)可对痕量的靶DNA片段进行特异性扩增, 在最适温度35~40 ℃时, 扩增反应时间仅需15 min, 其低温适应性和灵敏性等方面相比进口RPA技术产品有了新的突破, 而且摆脱美国专利壁垒。目前, 该方法现已被海军军医大学相关专家团队应用于其他病原体核酸的快速检测研究, 并已取得良好的应用效果。因此, 重组酶等温扩增技术具有潜在的、巨大的市场应用前景。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|