目的 探讨外周血、胸水结核感染效应T细胞检测(T-cell spot test for tuberculosis infection, T-SPOT.TB)及两者间的量效关系,同时进一步评估联合胸水腺苷脱氨酶(adenosine deaminase, ADA)对结核性胸膜炎的诊断价值。方法 对2017年1月至2020年12月在南通市第六人民医院就诊的80例结核性胸膜炎及70例非结核性胸膜炎相关检测数据进行分析。利用T-SPOT技术同时检测患者外周血及胸水中结核感染效应T细胞,采用速率法检测胸水中ADA。应用受试者工作特征曲线(receiver operator characteristic curve, ROC)取胸水ADA最佳临界值,比较不同临界值时的灵敏度与特异度。应用Person相性分析外周血与胸水T-SPOT.TB相关性。将外周血、胸水T-SPOT.TB及胸水ADA三者检测进行数据整合。结果 当胸水ADA>45 U/L时,诊断结核性胸膜炎的灵敏度和特异度分别为50.0%、94.3%;而取>25.15 U/L时,其灵敏度和特异度分别为80.0%和72.9%。胸水ADA>45 U/L,胸水/血T-SPOT.TB斑点数比值(spot forming cells, SFCs)>2倍,诊断结核性胸膜炎的特异度最高,为100%。25.15 U/L<胸水ADA≤45 U/L,胸水/血T-SPOT.TB斑点数比值>2倍,特异度92.3%(次之)。胸水ADA≤25.15 U/L,胸水/血T-SPOT.TB斑点数比值>2倍,特异度83.3%(3组中最低)。结论 胸水ADA水平的变化可用作诊断结核性胸膜炎常用方法之一。再进一步联合胸水及血T-SPOT.TB,若胸水/血T-SPOT.TB斑点数比值大于2倍,能进一步提高结核性胸膜炎的诊断率。
Objective To explore the relationship between peripheral blood and pleural effusion tuberculosis (TB) infection effector T cells, and to further evaluate the value of combined pleural effusion adenosine deaminase (ADA) for rapid diagnosis of tuberculous pleurisy.Methods The test data of 80 cases of tuberculous pleurisy and 70 cases of nontuberculous pleurisy treated in the Sixth People's Hospital of Nantong City from January 2017 to December 2020 were analyzed. The TB-infected effector T cells were also detected simultaneously in the peripheral blood and the pleural effusion by the T-SPOT technique, and the pleural effusion ADA was detected by the rate method. The subject operating characteristic curve (ROC) was applied to take the optimal pleural effusion ADA threshold to compare the sensitivity and specificity of different critical values. Person phase analysis was applied to analyze the correlation between peripheral blood and pleural effusion T-SPOT.TB. Data of peripheral blood, pleural effusion T-SPOT.TB and ADA were integrated.Results When pleural effusion ADA>45 U/L, the sensitivity and specificity for the diagnosis of tuberculous pleurisy were 50.0% and 94.3%, respectively; when ADA > 25.15 U/L, the sensitivity and specificity were 80.0% and 72.9%. When ADA > 45 U/L, pleural/blood T-SPOT.TB spot ratio (spot forming cells, SFCs) > 2 times, the specificity for the diagnosis of tuberculous pleurisy was 100% (highest); when 25.15 U/L< pleural effusion ADA ≤ 45 U/L, pleural/blood T-SPOT.TB spot ratio > 2 times, the specificity for the diagnosis of tuberculous pleurisy was 92.3% (second). When pleural effusion ADA ≤ 25.15 U/L, and the pleural effusion/blood T-SPOT.TB spot number ratio > 2 times, with 83.3% specificity (the lowest of the three groups).Conclusions The level of pleural effusion ADA is one of the most used methods for diagnosing tuberculous pleurisy. Further combination of pleural effusion and blood T-SPOT.TB, if the ratio of pleural effusion/blood T-SPOT.TB spots is greater than 2 times, it can further improve the diagnosis rate of tuberculous pleurisy.
结核性胸膜炎的确诊是指胸水中的抗酸杆菌或结核分枝杆菌培养阳性, 胸膜组织涂片活检, 或胸膜组织病理学, 提示干酪样坏死或肉芽肿性炎的典型变化。但是胸水、胸膜组织涂片阳性率很低[1]、培养阳性率低且时间过长[2], 约8周左右, 同时胸膜活检为有创性检查, 不适合所有患者, 且典型的干酪坏死性肉芽肿结构相对比较少见, 容易漏诊[3]。而现代检验医学中比较热门的基因检测技术如结核菌DNA、RNA检测, 可以提高结核菌检测阳性率约10%[4], 仍然不能满足临床快速精准诊断需要, 同时分子生物学技术易出现污染等情况, 结果的准确性值得考虑, 易出现误诊情况。检测胸水中腺苷脱氨酶(adenosine deaminase, ADA)是临床上诊断结核性胸膜炎最常用的辅助指标(ADA> 45 U/L具有较大辅助诊断价值), 是比较经典可靠的细胞因子检测靶标[5]。但在脓胸、类风湿性关节炎和其他疾病中, ADA也有不同程度的升高; 早期渗出旺盛期胸腔积液较多时, 大量胸水稀释, ADA可以不高, 但随着时间推移检测峰值会出现相对效应改变, 即作为早期敏感检测指标的特异性存疑[6]。结核性胸膜炎诊断难度较大, 其相关病原学依据较少, 在临床工作中, 主要依靠病史、症状、胸水常规及生化检测来进行初步判断并给予诊断性治疗的结核性胸膜炎诊断模式比较粗犷、草率, 容易出现误诊误治或者过诊过治, 并不适合现今追求精准医学的大环境或者大的社会背景。故此一种临床应用较为方便, 且患者认可度较高, 同时具有较高的灵敏度和特异度的结核性胸膜炎诊断方法的探寻具有深刻意义[7, 8]。我们已关注到有一部分文献尝试利用结核感染效应T细胞检测(T-cell spot test for tuberculosis infection, T-SPOT.TB)检测胸腔积液中结核感染效应性T细胞, 以提高对结核性胸膜炎的诊断率, 但在检测流程、检测结果与ADA交叉程度、与血液中结核感染效应性T细胞线性关系等方面未进行论证。本研究探讨外周血、胸水T-SPOT.TB联合胸水ADA对结核性胸膜炎的诊断检测价值, 为该疾病的早期诊断与治疗提供一定的理论依据。
收集2017年1月至2020年12月就诊于南通市第六人民医院结核科、呼吸内科的150例渗出性胸腔积液患者。根据结果将患者分为2组, 即结核性胸膜炎组(80例)和非结核性胸膜炎组(70例)。2组患者均进行外周血、胸水T-SPOT.TB、胸水ADA等检测。纳入标准:(1)所有纳入病例检测之前均签署患者知情同意书。(2)结核性胸膜炎诊断根据WS 288-2017《中华人民共和国卫生行业标准肺结核诊断》。结核性胸膜炎确诊标准:①胸腔积液涂片或结核菌培养阳性, 培养菌种鉴定为结核分枝杆菌复合群。②分子生物学检查:胸腔积液结核分枝杆菌核酸扩增检测阳性。③胸水或胸膜组织病理:提示肉芽肿性炎或干酪性坏死。符合以上3个标准中任意某一个可确诊。结核性胸膜炎临床诊断标准:①胸腔积液性质表明为渗出性, 主要分类为淋巴细胞。②胸水腺苷脱氨酶升高。③诊断性抗结核治疗是有效的。④同时具备以下3条中性任一条者, a:结核菌纯蛋白衍生物(PPD)试验中度阳性或强阳性, b:γ -干扰素释放试验呈阳性, c:结核抗体阳。(3)非结核性胸膜炎诊断标准:明确诊断其他疾病, 按照原发疾病治疗有效。肿瘤患者必须有明确的病理依据。排除标准:(1)HIV检测阳性。(2)年龄小于14岁。(3)近期接受过抗结核治疗。(4)妊娠期妇女。本研究通过南通市第六人民医院伦理审查(伦理号2017036)。
外周血单个核细胞(PBMC)提取:将外周血样本缓慢移动至15 mL离心管腔, 并添加1640培养基后, 每10 mL稀释1次, 然后倒入另一个 15 mL培养基中处理稀释的淋巴细胞, 并添加培养液3~ 4 mL细胞将血样均匀缓慢地加入培养基, 将细胞与培养液分离上层即可(添加缓慢, 不能破坏分离液液面), 然后开始离心, 使用离心力1 000 × g, 温度18 ℃, 时间22 min。分离完毕后, 将外周的单个多核细胞液从无菌Ficoll分离管腔中抽移注入到一个新制备的无菌的15 mL的离体心管中。
胸水单个核细胞(PEMC)提取:方法原理与对正常人外周血单个核细胞标本的常规体外培养提取术相比较类似, 根据对患者胸腔液进行体外穿刺, 取胸水约8~10 mL, 肝素钠抗凝处理, 然后将患者胸水样本分别移至容量15 mL的离体心管中, 加入1640培养基并进行稀释, 稀释的胸腔积液样品慢滴均匀加入分离液培养基的上层(慢加)进入, 不能摧毁分离液液面, 然后开始离心, 使用离心力1 000 × g, 温度18 ℃, 时间22 min。分离后, 单个核细胞从无菌Ficoll的隔离管腔转移到一个新制作的无菌管中。
胸水ADA检测:根据ADA含量测定方法描述及其产品使用检测方法进行操作, 应用高速离心速率法, 收集患者胸腔积液标本约4~5 mL, 注入抗凝酶玻璃管, 置入高速离心机系统中, 以2 000 r/min(离心半径为10 cm)继续离心约10 min。取回其上的清液, 应用AU5400全自动生化仪测定胸水ADA活性。
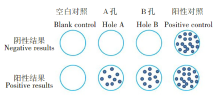
阳性判定标准:当阴性对照孔内斑点小于6时, ESTA-6孔(抗原A)或CFP-10孔(抗原B)减去阴性对照孔的数量不少于6个, 判断结果为阳性。当阴性对照孔中斑点大于6时, ESTA-6孔(抗原A)或CFP-10孔(抗原B), 任何实验孔中的斑点数量大于阴性对照中的斑点数量的2倍, 则判断结果为阳性。阴性判定标准:如果实验有效, 阳性对照孔的结果良好, 但存在问题如果2个孔ESTA-6孔和CFP-10孔均不符合阳性标准, 则应判断实验结果为阴性。判定结果示意图如图1所示。
胸水/外周血T-SPOT.TB根据斑点数比值判断, 斑点数比值是指胸水任一实验孔(A孔/B孔)中的斑点数量与相对应外周血中实验孔(A孔/B孔)斑点数的比值, 以最大反应比值为基准。
根据ADA水平分为< 25.15 U/L和≥ 25.15 U/L组, 分别做胸水T-SPOT.TB和外周血T-SPOT.TB的相关性及散点图。为进一步探索外周血、胸水T-SPOT.TB和胸水ADA对结核性胸膜炎的诊断价值, 根据胸水ADA诊断金标准和本组检测数据最终确定的可用性胸水ADA界值、将胸水ADA检测结果分成3组, 即ADA> 45 U/L、25.15 U/L< ADA≤ 45 U/L以及胸水ADA≤ 25.15 U/L, 分别探讨与之相对应的外周血、胸水T-SPOT.TB检测结果相互之间逻辑关系, 即判断各组数据交叉结果对结核性胸膜炎的诊断价值。
应用IBM SPSS24.0软件进行统计分析, Medcalc软件绘制ROC曲线。连续变量资料统计描述如满足正态分布采用x± s表示, 不满足时采用M(P25, P75)表示, 假设检验采用t检验或秩和检验; 分类变量资料采用例数和率表示, 假设检验采用χ 2检验。连续变量采用ROC曲线法计算灵敏度、特异度等, 分类变量资料采用四格表进行计算。
在结核性胸膜炎组中, 外周血和胸水T-SPOT.TB检测阳性率分别为92.5%和78.8%, 而非结核性胸膜炎组其分别为21.4%和12.9%。两种检测方法比较显示, 结核性胸膜炎组的阳性率明显高于非结核性胸膜炎组, 差异均有统计学意义(P< 0.05)。见表1。
| 表1 外周血与胸水T-SPOT.TB检测阳性率的比较 Table 1 Comparison of the positive rate of peripheral blood and pleural T-SPOT.TB |
80例结核性胸膜炎组中有63例患者外周血和胸水T-SPOT.TB同时反应阳性, 其中52例胸水T-SPOT.TB斑点数较对应外周血T-SPOT.TB斑点数比值达2倍以上, 11例胸水T-SPOT.TB斑点数较对应外周血T-SPOT.TB斑点数比值在2倍以内; 70例非结核性胸膜炎组中, 有9例患者外周血和胸水T-SPOT.TB同时检测结果为阳性, 其中2例胸水T-SPOT.TB斑点数较对应外周血T-SPOT.TB斑点数比值达2倍以上, 7例胸水T-SPOT斑点数较对应外周血T-SPOT.TB斑点数比值在2倍以内。
结核性胸膜炎组ADA值M(P25, P75)为42.80 (26.25, 56.00), 非结核性胸膜炎组为23.70 (13.00, 27.20), Z值6.518, 采用非参数秩和检验, 结核性胸膜炎组ADA水平高于非结核性胸膜炎组, 差异有统计学意义(P< 0.05)。
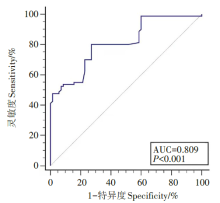
采用ROC曲线法, 知胸水ADA活性诊断结核性胸膜炎时曲线下面积AUC为0.809 (95%CI:0741~0.876)。当约登指数达到最大值0.683时, 取ADA临界值为25.15 U/L, 此时诊断结核性胸膜炎的灵敏度和特异度分别为80.0%和72.9%。若取传统ADA临界值45 U/L时, 则其灵敏度和特异度分别为50.0%和94.3%。因此本研究得到ADA临界值视为可用性临界值。ROC曲线图见图2。
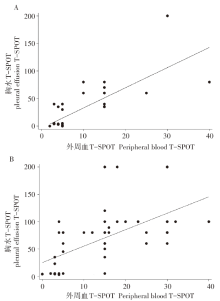
当胸水ADA< 25.15 U/L时, 皮尔逊相关系数为0.776, P< 0.001; 当胸水ADA≥ 25.15 U/L时, 皮尔逊相关系数为0.630, P< 0.001, 两组间相关性检验均有统计学意义。外周血与胸水T-SPOT.TB散点图见图3。
当胸水ADA> 45 U/L, 胸水/血T-SPOT.TB斑点数比值> 2倍, 特异度100.0%; 胸水/血T-SPOT.TB斑点数比值2倍以内, 特异度90.0%; 两者均阴性, 特异度50.0%。25.15 U/L< 胸水ADA≤ 45 U/L, 胸水/血T-SPOT.TB斑点数比值> 2倍, 特异度92.3%; 胸水/血T-SPOT.TB斑点数比值2倍以内, 特异度77.8%; 两者均阴性, 特异度63.6%。当胸水ADA≤ 25.15 U/L, 胸水/血T-SPOT.TB斑点数比值> 2倍, 特异度83.3%; 胸水/血T-SPOT.TB斑点数比值2倍以内, 特异度3.5%; 两者均阴性, 特异度3.0%。见表2。
| 表2 诊断结果 Table 2 Diagnostic results |
结核性胸膜炎是胸腔积液最常见的原因之一[9]。结核性胸膜炎要坚持早期诊断、早期及时采取综合干预措施, 才能缓解患者症状, 提高生活质量, 减少并发症。但结核性胸膜炎发病过程缓慢, 通常在结核分枝杆菌感染机体后6~12周出现明显的生理病理变化[10], 早期诊断缺乏一些特异性方法[11]、因为影像学检查、PPD皮试、胸水常规检查等缺乏特异性; 结核菌涂片/培养阳性率极低; 核酸扩增检测技术能适度提高结核菌检出率但仍然偏低、远远达不到诊断基本要求; 胸膜活检不典型病理太多, 且因技术条件限制并不适合基层医疗机构使用。胸水ADA检测是被广泛认可的传统“ 金标准” 诊断方法, 但在标准线(> 45 U/L)上的灵敏度太低、确切概率不能完全解决诊断难题。为了能早期快速精准提高结核性胸膜炎诊断水平, 在既往检测技术的基础上, 寻找一种新的检测方法来实现这一目标至关重要。
传统上广泛接受的胸水ADA的诊断界值为45 U/L, 近来也有对胸水ADA最佳界值的不同报道, 尉艳霞等[12]发现在胸水ADA中以28.7 U/L为临界值可以很好的鉴别良恶性胸腔积液; 罗虎等[13]通过分析提出以23.3 U/L为截断值时, 结核性胸腔积液的诊断灵敏度特异度可分别达到94.8%和92.8%。依靠ADA水平来判断是否为结核性胸膜炎并不严谨, 本研究利用ROC曲线取胸水ADA最佳临界值是25.15 U/L, 低于传统广泛认可的45 U/L, 这与近期发表的研究结果基本相仿[14], 原因可能是与患者年龄、种族、ADA的检测方式、样本量多少有关[15, 16]。本研究发现, 当胸水ADA> 45 U/L时, 诊断结核性胸膜炎的灵敏度和特异度分别为50.0%、94.3%; 而取> 25.15 U/L时, 其灵敏度和特异度分别为80.0%和72.9%。既往在临床工作中通常认为, 当胸水ADA升高时, 可初步诊断为结核性胸膜炎, 然而鉴别诊断难度较大, 不易与其他感染性胸腔积液、癌性胸腔积液等进行区分, 容易出现漏诊或误诊现象[17, 18]。
结核性胸膜炎发病机制相对复杂, 但影响本疾病的主要因素为结核菌菌量的高低、致毒活力的大小, 以及机体本身抗结核免疫的能力[19]。结核病患者免疫反应机制中, 免疫反应性细胞主要是CD4+T淋巴细胞[20], 结核性胸膜炎免疫反应主要集中在胸膜腔, 这一细胞属性导致结核性胸腔积液中富含大量的CD4+T淋巴细胞, 即结核感染特异性CD4+T淋巴细胞在胸水中出现富集现象[21]。本组研究结果提示80例结核性胸膜炎患者中有52例胸水T-SPOT.TB斑点数较对应外周血T-SPOT.TB斑点数比值达2倍以上, 11例结核性胸水T-SPOT.TB斑点数较对应外周血T-SPOT斑点数比值在2倍以内, 胸水T-SPOT.TB相对血液T-SPOT.TB有更高的特异度, 间接证明胸水 T-SPOT.TB检测对TBP的诊断可能会更有意义, 本研究根据前期的检测结果、通过相对应数据间的分组、整合, 对胸水ADA金标准和ADA可用性临界值分组, 可以看到当胸水ADA> 45 U/L, 胸水/血T-SPOT.TB斑点数(SFCs)比值> 2倍, 特异度100%。当25.15 U/L< 胸水ADA≤ 45 U/L, 胸水/血T-SPOT.TB斑点数(SFCs)比值> 2倍, 特异度92.3%。当胸水ADA≤ 25.15 U/L, 胸水/血T-SPOT.TB斑点数(SFCs)比值> 2倍, 特异度83.3%。
胸水ADA大于传统临界值45 U/L时, 对结核性胸膜炎已经具有很高的辅助诊断价值(特异度94.3%)[5], 而从本研究可以看到:当胸水ADA大于 45 U/L的同时, 胸水和血T细胞斑点数又存在2倍以上的关系, 更进一步提高了结核性胸膜炎诊断价值(特异度100%)。即使胸水ADA小于传统临界值 45 U/L, 甚至小于本组可用性临界值25.15 U/L, 但如果胸水/血效应T细胞斑点数存在2倍以上的关系, 对结核性胸膜炎的诊断特异性依然有不同程度的提高, 弥补了胸水ADA敏感性提高、特异度下降的弊端。综上所述, 认为血、胸水T-SPOT.TB联合胸水ADA对结核性胸膜炎的诊断具有一定的可行性。
利益冲突声明 所有作者声明不存在利益冲突
编辑:王佳燕
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|