作者简介:邹盛华(1974—),男,本科,副主任检验师,研究方向:微生物检验。
目的 探讨马尔尼菲篮状菌( Talaromyces marneffei, T. marneffei)感染引发马尔尼菲篮状菌病(Talaromycosis marneffei,TSM)的临床特征和早期诊断方法,以减少TSM患者病死率。方法 收集福州肺科医院2017年1月—2021年12月确诊18例TSM患者的临床特征和微生物学检测资料,并进行描述性分析。结果 18例患者均通过传统培养及MALDI-TOF MS方法确诊为 T. marneffei感染,主要感染部位为肺和淋巴结,患者伴有咳嗽、咳痰和发热等临床表现。影像学常见斑片影、纵隔淋巴结影和结节影等。微生物检测显示,涂片与培养比较,培养阳性率较高,差异有统计学意义( χ2=13.74, P<0.05)。血液、支气管灌洗液、痰液培养阳性率分别为60.0%(9/15)、26.7%(4/15)和5.6%(1/18),脓液、骨髓、胸水及脑脊液各1例培养阳性;临床标本直接涂片痰和脓液各1例阳性,其余均阴性。菌落特征显示,25 ℃培养菌落形态为菌丝相,产生红色色素,镜下可见单轮生或双轮生帚状枝; 35 ℃为初期呈酵母相,5~6 d后转为菌丝相; 37 ℃呈酵母相,镜下可见酵母样细胞。18例TSM患者使用抗真菌药物后均好转。与非HIV合并TSM患者相比,HIV合并TSM患者常见白细胞减少和贫血,差异显著有统计学意义( P<0.05)。结论 T. marneffei感染分为局限型和播散型,常入侵肺部或皮肤、淋巴结等部位。患者主要表现为发热、咳嗽、咳痰等不典型症状。 T. marneffei感染确诊多依靠真菌培养,MALDI-TOF MS方法的应用可缩短TSM确诊时间。临床特征结合微生物学分析为TSM患者的早期诊断提供了客观依据,及时使用抗真菌治疗可以改善患者的预后。
Objective To investigate the clinical characteristics and early diagnostic methods of patients with Talaromyces marneffei infection, so as to reduce the mortality of patients.Methods The clinical characteristics and microbiological analysis data including fungal culture, smear examination and mass spectrometry were collected from 18 patients with Talaromyces marneffei infection in the Department of Respiratory Medicine, Department of Tuberculosis, and Department of Critical Respiratory Medicine in Fuzhou Pulmonary Hospital from January 2017 to December 2021, and descriptive analysis was conducted.Results All the 18 patients were confirmed to be infected with Talaromyces marneffei by conventional culture and matrix-assisted laser desorption/ionization-time of flight (MALDI-TOF) mass spectrometry (MS). The main infection sites of 18 patients with Talaromyces marneffei infection were lungs and lymph nodes, and the patients were accompanied by clinical manifestations such as cough, sputum and fever. The imaging features such as patchy shadows, mediastinal lymph node shadows and nodular shadows were common. Microbiological testing showed a statistically significant difference between smear and culture with a higher positive culture rate ( χ2=13.74, P<0.05). The positive rate of blood culture in microbiological test was 60.0% (9/15), the positive rate of bronchial lavage fluid culture was 26.7% (4/15), the positive rate of sputum culture was 5.6% (1/18), one case each of pus, bone marrow, pleural fluid and cerebrospinal fluid was positive for culture and the other cases were negative, one case of sputum and one case of pus were positive for smear and the rest were negative. Colony characteristics showed that the colony morphology was mycelial phase at 25 ℃, producing red pigment, and the branching pattern of the penicillus was seen microscopically as monoverticillate or biverticillate; At 35 ℃, the yeast phase appeared at the initial stage, and then the mycelium phase changed after 5-6 days; the yeast phase was observed at 37 ℃, and yeast-like cells were seen under the microscope. All 18 patients with Talaromyces marneffei infection got better after using antifungal drugs. Compared with non-HIV patients with Talaromyces marneffei infection, leukopenia and anemia were common in HIV patients with Talaromyces marneffei infection, and the differences were statistically significant ( P<0.05).Conclusions The infection of Talaromyces marneffei can be divided into localized type and disseminated type, which usually invade the lungs, skin, lymph nodes and other places. The main manifestations of patients are fever, cough, phlegm and other atypical symptoms. At present, the diagnosis of Talaromyces marneffei infection is mostly based on the fungal culture test, and the application of MALDI-TOF MS method can effectively shorten the diagnosis time of Talaromycosis marneffei. Clinical characteristics combined with microbiological analysis provide an objective basis for early diagnosis of patients with Talaromyces marneffei infection, and timely use of antifungal therapy can improve the prognosis of patients.
马尔尼菲篮状菌(Talaromyces marneffei, T. marneffei)也称为马尔尼菲青霉菌, 是温度依赖性双相真菌, 25 ℃呈菌丝相, 37 ℃呈酵母相, 竹鼠被认为是其重要的自然宿主。T. marneffei属于条件致病性真菌, 是引起呼吸、皮肤和全身真菌病重要的双相型真菌[1]。T. marneffei传播途径并不明确, 目前公认的传播途径是经呼吸道吸入T. marneffei孢子导致感染[2], 主要侵犯免疫功能低下者的单核吞噬细胞系统, 首先引起肺部感染, 常见于艾滋病患者的继发感染。在泰国北部, T. marneffei感染是继肺结核和隐球菌病后第三种艾滋病患者常见疾病, 有报道显示晚期艾滋病患者感染病死率可达30%[1, 2, 3, 4, 5]。近年来, T. marneffei在非艾滋病人群中的感染病例逐渐增多, 有报道我国南部非艾滋病儿童播散性的感染死亡率高达36.36%[6]。研究发现血液恶性肿瘤、结肠癌、重症肌无力、混合结缔组织疾病、移植排斥反应、系统性红斑狼疮、糖尿病、皮质类固醇、免疫抑制剂使用或抗IFN-γ 自身抗体升高者等非艾滋病人群容易感染T. marneffei[7, 8, 9]。本研究收集分析18例马尔尼菲篮状菌病(Talaromycosis marneffei, TSM)患者的临床资料, 并对患者临床标本进行真菌培养和涂片检查。探讨TSM患者的临床特征和早期有效的诊断方法, 以减少病死率。
1.1.1 病例资料和样本采集 2017年1月— 2021年12月, 收集本院呼吸内科、结核科和重症呼吸科18例TSM患者的临床资料和送检的临床样本, 其中包括血液、痰液和支气管灌洗液, 部分患者送检胸腔积液、骨髓、脑脊液和病变部位脓液。本项目研究已获得单位医学伦理委员会批准以及患者知情及签字认可。
1.1.2 仪器和试剂 二级生物安全柜(哈东联BSC-1360L II B2), 全自动血培养仪(BD BACTEC FX200), 电热恒温培养箱(上海精宏DNP-9162, 25 ℃、35 ℃、37 ℃各1台), 自动染片机(珠海贝索BSZ-TH148)。真菌血培养瓶(美国BD公司), 血琼脂培养基、巧克力培养基、沙堡弱培养基(sabouraud dexteose agar, SDA)及念珠菌显色培养基(郑州贝瑞特生物技术有限公司)。革兰染色液、美兰染色液、乳酸酚棉兰染色液和六胺银染色液(珠海贝索生物技术有限公司)。MALDI-TOF MS仪(法国生物梅里埃股份有限公司, 数据库版本V3.0, RUO模式); VITEK MS-CHCA基质液(主要成分为α -氰基-4羟基肉桂酸)、VITEK MS-FA(主要成分为甲酸, 酵母菌前处理液)、VITEK MS-DS靶板(法国生物梅里埃股份有限公司); 质控菌株白念珠菌(ATCC10231)、大肠埃希菌(ATCC25922)、铜绿假单胞菌(ATCC27853)和金黄色葡萄球菌(ATCC25923)。
1.2.1 传统培养 采集血液10 mL接种于含溶血素的真菌培养瓶中, 置BD BACTEC FX200中进行培养, 仪器阳性报警后转种血琼脂培养基、巧克力培养基和SDA各2份, 分别置25 ℃和35 ℃孵育; 无菌体液标本接种双相培养瓶, 35 ℃孵育, 固相培养基上有明显菌落生长后置25 ℃孵育; 痰液和支气管灌洗液直接接种于SDA各2份, 分别置25 ℃和35 ℃孵育。所有T. marneffei菌丝相菌落转种SDA和念珠菌显色培养基各3份, 分别置25 ℃、35 ℃和37 ℃孵育, 观察3、4及 5 d菌落转相及色素产生情况。取25 ℃、35 ℃和37 ℃环境下孵育的菌落涂片, 分别进行革兰染色、美兰染色、乳酸酚棉兰染色和六胺银染色, 显微镜下观察菌体的形态特征。
1.2.2 MALDI-TOF MS鉴定 利用甲酸乙腈法对35 ℃ SDA培养5 d的T. marneffei菌落进行前处理, 用湿润的拭子挑取2~3个菌落, 置于含 300 µ L 去离子水1.5 mL微量离心管中, 接着加900 µ L无水乙醇混合, 离心去除上清液, 将所有管子干燥 2~5 min去除残留乙醇, 加 10 µ L 70% 甲酸混合, 接着加10 µ L乙腈混匀, 离心后得含有提取蛋白的上清液。将 1 µ L蛋白质提取物置于板上, 在室温干燥, 然后加入 1 µ L α -氰基-4-羟基肉桂酸基质溶液。将板在室温下干燥, 然后放入仪器中进行分析。专用分析软件对鉴定结果进行判读, 数据库版本为V3.0。
使用GraphPad Prism 5和IBM SPSS Statistics 21.0软件完成统计学分析。正态分布的计量资料使用x± s表示, 采用t检验; 不符合正态分布的计量资料, 使用中位数M(P25, P75)表示, 采取Mann-Whitney U秩和检验; 计数资料采用χ2分析; 以P< 0.05为差异有统计学意义。
18例TSM患者均经传统培养及MALDI-TOF MS方法鉴定确诊为T. marneffei感染, 感染部位常见于肺部和淋巴结, 分别为18例和9例, 胸膜、脾脏、脑部、锥柱、腹膜分别为2、2、2、1和1例; 临床表现常见为咳嗽、咳(血)痰和发热, 分别为17例(占94.4%)、15例(占83.3%)和11例(占61.1%), 其他气喘/气促、寒战/畏冷、头痛/头晕、胸闷、右侧胸痛、乏力、湿啰音分别为4、2、2、1、1、1、1例; 肺部影像学常见有斑片状、纵隔淋巴结影、结节状和索条状, 分别为12例、10例、10例和8例, 其他磨玻璃影、胸膜增厚、弥漫性粟粒样影、胸腔积液分别为4、4、2、1例; 经两性霉素B、伏立康唑、氟康唑、米卡芬净抗真菌治疗转归分别为8、5、3和2例。18例TSM患者中发生合并HIV感染7例, 其中男6例, 女1例, 年龄(42.14± 4.54)岁, 病程M(P25, P75)为4(2, 4)周, 无合并HIV感染11例, 其中男9例, 女2例, 年龄(54.00± 4.84)岁, 病程M(P25, P75)为4.5(4, 5.75)周, 差异均无统计学意义(χ2=0.010, -1.620, P> 0.05)。
18例TSM患者采集痰、灌洗液、脓液、骨髓、胸水、脑脊液、全血进行涂片和培养检查, 结果培养阳性率较高, 差异有统计学意义(χ2=13.74, P< 0.05), 见表1。
| 表1 马尔尼菲篮状菌病18例患者各类标本涂片和培养比较 Table 1 Comparison of smear and culture results of various types of specimens from 18 patients with Talaromycosis marneffei |
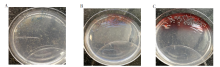
25 ℃培养T. marneffei菌落呈菌丝相, 初代分离菌落生长速度缓慢。在SDA上, 菌落呈灰白色绒毛状, 3 d菌落肉眼可见, 4 d开始菌落产生少许红色色素(图1A), 5 d菌落产生大量红色色素(图1B), 6 d菌落红色色素弥散到整个培养基中(图1C), 10 d左右菌落不再增大。在血琼脂培养基上, 菌落呈浅灰白色膜状, 5 d以后菌落产生白色气中菌丝, 浅灰白色膜状(图2A)。在巧克力培养基上, 菌落呈浅灰褐色膜状, 5 d以后菌落产生灰褐色绒样气中菌丝, 浅灰褐色膜状(图2B)。在SDA菌落呈菌丝相, 灰白色绒毛状, 产生大量红色色素(图2C)。在念珠菌显色培养基上, 菌落呈蓝灰色菌落, 4 d开始菌落产生红色色素, 弥散到培养基中(图3)。
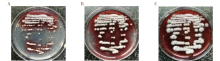 | 图1 马尔尼菲篮状菌25 ℃不同时间SDA的图像 A. 4 d; B. 5 d; C. 6 d。Fig. 1 The colony image of T. marneffei were in SDA at 25 ℃ at different time A. On the fourth day; B. On the fifth day; C. On the sixth day. |
在SDA上, 35 ℃培养初期T. marneffei菌落呈酵母相, 延长培养时间至5~6 d, 菌落呈菌丝相, 较25 ℃生长稍慢。在SDA上, 25 ℃培养6 d , 菌落灰白色绒毛状, 产生大量红色色素(图4A)。菌丝相菌落转种血琼脂培养基后置于35 ℃培养3 d, 菌落呈菌丝相和酵母相混合同时生长(图4B), 经镜检验证图5B中白色产气中菌丝的菌落是菌丝相, 而灰色小菌落是酵母相。菌丝相菌落转种SDA后置于35 ℃, 历经3周时间培养, 菌落反复传代5次以上, 均没能培养出酵母相菌落。
在SDA上, 37 ℃培养菌落呈酵母相, 较25 ℃和35 ℃生长缓慢。孵育3~4 d可见菌落与35 ℃初期菌落类似, 不产红色素(图4C)。菌丝相菌落转种SDA后置于37 ℃孵育, 菌落转相容易, 3 d培养出酵母相菌落。
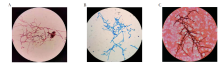
T. marneffei菌落25 ℃培养3 d分别进行革兰、美兰和六胺银染色, 菌体可见分枝分隔菌丝, 未见分生孢子和帚状枝(图5); 培养4 d菌落乳酸酚棉兰染色可见分枝分隔长菌丝(图6A), 培养5 d后菌落革兰染色可见分枝分隔菌丝、卵圆形分生孢子及形态典型帚状枝(图6B); 培养6 d以上菌落美兰染色可清晰辨认卵圆形分生孢子和分枝分隔菌丝并见典型的帚状枝(图6C)。
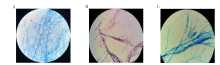
在SDA上, T. marneffei 35 ℃培养3 d, 呈酵母相菌落, 乳酸粉棉兰染色可见卵圆形分生孢子(图7A), 革兰染色可见蓝紫色的卵圆形分生孢子, 菌体稍长, 延时培养至5~6 d, 对温度要求不严格, 25 ℃~35 ℃均可以, 菌落由酵母相转变成菌丝相, 革兰染色可见卵圆形分生孢子和分枝分隔菌丝(图7B); 培养6 d以上, 革兰染色仅见分枝分隔菌丝(图7C)。
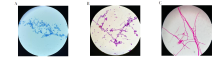
在SDA上, T. marneffei 37 ℃培养4 d, 呈白色酵母相菌落(图4C)。乳酸粉棉兰染色油镜镜检可见卵圆形分生孢子和卵圆形或圆形、直径约3 µ m的酵母样细胞, 与图7A类似。
T. marneffei可引起全身播散性感染, 累及全身多个器官, 包括淋巴、骨髓、肝、脾等, 其中肺部是常见侵犯的首发部位[10]。本研究T. marneffei感染肺部的比例高达100.0%, 与上述观点一致。T. marneffei感染病症复杂, 在症状、体征和影像上缺乏特征性表现, 易误诊而延误治疗, 本研究18例患者初诊时只有3例诊断为TSM。国内学者报道MALDI-TOF MS能100.0%正确识别T. marneffei临床分离株[11], 本研究18例TSM患者均通过MALDI-TOF MS鉴定确诊为T. marneffei菌感染。另外, T. marneffei分布以血液为主, 有9例患者血液培养阳性, 对于此类患者实验室检查中血液真菌培养尤为重要, 特别是本研究发现血液真菌培养检测相比较于真菌涂片检测效果可能更好, 真菌培养在不同样本(痰、灌洗液、脓液、骨髓、胸水和全血)中均出现阳性。由于T. marneffei较一般致病性真菌生长慢, 建议适当延长培养时间, 并且使用专用真菌培养瓶, 因为T. marneffei常为细胞内寄生, 破坏细胞后阳性率会提高。目前治疗HIV合并TSM的首选药物是两性霉素B, 继而口服伊曲康唑200 mg/d的剂量维持至CD4+T> 100 /μ L[12]。本研究7例HIV合并TSM, 前 2周诱导期使用两性霉素B 0.5~0.7 mg/(kg· d)-1或两性霉素B脂质体3~5 mg/(kg· d)-1静脉滴注, 继而口服伊曲康唑400 mg/d 10周。HIV阴性TSM病例可口服伊曲康唑400 mg/d 8周后改为200 mg/d, 至CD4+T淋巴细胞计数> 100 /μ L且持续6个月。国内报道用伏立康唑联合伊曲康唑治疗肾移植合并TSM患者取得良好效果[13], 本研究有5例HIV阴性TSM病例使用伏立康唑治疗方案病情均好转:①诱导期每次静脉滴注伏立康唑6 mg/kg, 每12 h 1次, 疗程为1 d, 然后改为每次静脉滴注4 mg/kg, 每12 h 1次, 疗程至少3 d; 巩固期口服伊曲康唑200 mg, 2次/d, 疗程不超过12周。②口服伏立康唑400 mg, 每12 h 1次, 疗程为1 d, 而后改为200 mg口服, 每12 h 1次, 疗程为12周。本研究表明抗真菌药物如两性霉素B、氟康唑、伊曲康唑和米卡芬净的使用后患者病情均为好转, 有文献证实使用抗真菌药物如两性霉素B和伊曲康唑药量足, 疗程长, 通常可收到较好疗效[14]。
T. marneffei是艾滋病患者常见的继发真菌之一。研究显示HIV继发TSM与非HIV继发TSM的患者相比, 常见贫血和白细胞减少, 二者差异显著, 有统计学差异(P< 0.05)。一项针对中国东南部的回顾性研究显示, HIV患者贫血的患病率为55.15%, 轻度、中度和重度贫血的总患病率分别为41.42%、11.08%和2.64%, 分析HIV患者罹患贫血的原因可能是CD4数量较低、HIV病毒对骨髓造血干细胞抑制以及HIV感染属于长期消耗性疾病导致的机体营养不良使得造血原料不足[15, 16]。T. marneffei患者合并艾滋病的患者发生贫血症状, 除HIV病毒对机体的影响, 也可能与T. marneffei有关, 感染T. marneffei患者同样可发生骨髓抑制, 除此之外, T. marneffei可导致溶骨性破坏、微血管病性溶血性贫血以及血小板减少造成的机体失血[16, 17]。研究发现免疫功能正常的宿主感染T. marneffei后, 引起全身严重炎症反应, 白细胞可显著增高[18], 而HIV患者免疫系统受损, 白细胞数量降低[19], T. marneffei感染后白细胞数量也处于降低状态[20]。因此对于HIV患者, 就诊时发生贫血和白细胞降低的症状也应高度警惕T. marneffei的感染。
T. marneffei属于篮状菌属条件致病菌, 是300多个青霉菌中唯一的温度依赖性双相型真菌[21, 22]。其菌落特点具有诊断意义, 在25 ℃时呈菌丝相产生红葡萄酒色素, 而37 ℃时呈酵母相不产红色色素。本研究发现T. marneffei在SDA上, 35 ℃培养初期(3 d内)菌落呈酵母相, 从酵母相转变为菌丝相较容易, 只需要放置室温延长1~2 d即长出分枝分隔菌丝, 3~4 d即长出帚状枝并产生红葡萄酒色素, 且对温度要求不是特别严格。微生物常规培养都在35 ℃孵育, 培养皿仅保留3 d, 为此, 如果临床怀疑T. marneffei感染, 为了避免漏诊和误诊, 应该延长培养时间。而从菌丝相转变为酵母相则对温度要求严格, 菌丝相菌落转种SDA后置于35 ℃, 历经3周时间, 反复传代5次以上, 均没能培养出T. marneffei的酵母相菌落; 而置于37 ℃只需 3 d即转相成功, 菌落呈酵母相, 乳酸粉棉兰染色油镜镜检可见卵圆形分生孢子、卵圆形或圆形、直径约3 µ m的酵母样细胞。菌丝相菌落转种血琼脂培养基后置于35 ℃, 出现两种菌落, 部分呈酵母相, 膜状, 浅灰褐色, 湿润; 部分呈菌丝相, 灰白色绒毛状。T. marneffei是酵母相还是菌丝相与培养基、生存环境、温度有极大关系。T. marneffei二相之间的转换, 需经过一个短棒状或畸形的过渡期, 尤其菌丝相转酵母相对温度的依耐性近乎严苛, 必须在37 ℃孵育下才能成功。在组织中应为酵母相, 而且只有酵母型才有致病性。
本研究应用4种染色方法对T. marneffei生长繁殖过程的形态进行染色对比分析, 25 ℃培养物:革兰染色结晶紫不易上色, 分生孢子为蓝紫色着色不均, 菌丝体容易脱色过度, 染成红色, 但是不影响分枝分隔菌丝和帚状枝的辨别; 碱性美兰染色能清晰观察到帚状枝, 辨别分枝分隔菌丝及分生孢子的菌体形态; 六胺银染色清晰可见分枝分隔菌丝, 着色更深, 适于菌丝体染色; 乳酸酚棉兰染色可见分枝分隔菌丝, 分隔清晰, 适于活体染色, 层次分明, 立体感强。35 ℃培养物:不同时间的培养物形态各异, 初期酵母相菌落见卵圆形稍长的孢子, 延时培养出现菌丝相后可见分枝分隔菌丝和典型帚状枝的形态, 碱性美兰染色也能取得很好的效果。37 ℃培养物:可见卵圆形孢子及少许短菌丝, 革兰染色效果较好, 碱性美兰染色孢子的结构不够清晰。真菌染色方法常见的还有荧光染色, 但是相较之下, 革兰染液和美兰染液更容易获得, 价格也更便宜。
综上所述, TSM患者结合临床特征、影像学和微生物检测如真菌培养, 涂片检测, 有利于提高T. marneffei的检出率, 早期干预治疗对提升患者的生存率至关重要。
利益冲突声明 所有作者声明不存在利益冲突
编辑:符式刚
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|