作者简介:梁婉欣(1995—),女,在读研究生,研究方向:新型冠状病毒假病毒系统构建及应用。
目的 构建新型冠状病毒(SARS-CoV-2)假病毒,优化假病毒制备条件并应用于中和抗体活性检测。方法 优化合成SARS-CoV-2 刺突蛋白(S)基因,进行假病毒包装;通过Western blot检测S 基因的表达;应用定量ELISA检测接种新冠灭活疫苗后血清中新型冠状病毒IgG抗体的滴度,同时应用假病毒中和实验对接种新冠疫苗后血清中和抗体活性进行评价。结果 成功构建了整合SARS-CoV-2 S基因的表达载体pcDNA3.1-S,确定pNL4-3.Luc.R-E-∶pcDNA3.1-S最佳转染比例为2∶1,可成功包装出高滴度的假病毒粒子。Western blot结果表明S蛋白已成功地在假病毒中进行表达。SARS-CoV-2假病毒可感染Vero、Huh7.5、A549-hACE2和293T-hACE2等4种靶细胞,表明所构建的假病毒具有感染活力,且具有广泛的宿主范围,其中293T-hACE2细胞感染假病毒后相对其他细胞株可检测出更高的萤火虫荧光素酶活性。ELISA检测接种新冠疫苗后收集的血清,结果表明接种第二针灭活疫苗一周后可检测出较高血清IgG滴度(S/CO=10.27±3.33),半年后血清IgG滴度降低(S/CO=2.36±2.25);假病毒中和实验结果表明1例IgG阳性(S/CO=10.32)免疫后血清可有效抑制SARS-CoV-2 假病毒的感染活力,中和效价达到1/1 066。结论 成功构建SARS-CoV-2 假病毒,该假病毒可用于后续有关SARS-CoV-2中和抗体活性检测和疫苗接种后体液免疫效果的评价研究。
Objective To construct SARS-CoV-2 pseudovirus, optimize its preparation protocol, and apply it to the evaluation of antibody neutralization activity.Methods The optimized sequence of spike (S) gene of SARS-CoV-2 was synthesized, the pseudovirus titers were measured, and the expressed S protein was then detected by Western blot. Finally, quantitative ELISA was used to measure the serum IgG antibody titers in recipients who had received either one or two doses of COVID-19 inactivated vaccine. Meanwhile, the sera were tested for their reactivity with the pseudovirus using neutralization tests.Results S gene was confirmed to have been successfully cloned into the vector, generating the pcDNA3.1-S plasmid. Co-transfection of pNL4-3.Luc.R-E- and pcDNA3.1-S at a ratio of 2∶1 could lead to higher packing efficacy and pseudovirus titers. Expression of the S protein was verified by Western blot. Moreover, this SARS-CoV-2 pseudovirus showed a broad host infectivity in Vero, Huh7.5, A549-hACE2 and 293T-hACE2 cells, with the highest relative luciferase unit (RLU) in 293T-hACE2. Comparing the IgG levels measured by ELISA in sera collected from COVID-19 vaccine recipients, we observed a higher titer in those who received two doses of inactivated vaccine (S/CO=10.27±3.33), measured one week after the second shot. However, the IgG level significantly dropped ( S/CO=2.36±2.25) half year post-vaccination. Amongst the serum samples tested, one with an S/CO of 10.32 could successfully inhibit the infection of SARS-CoV-2 pseudovirus in 293T-hACE2 cells at a dilution of 1/1 066.Conclusion We have established a method for preparing the SARS-CoV-2 pseudovirus, which can be used for detection of the neutralizing antibodies and the evaluation of humoral immune response post-vaccination.
2019年, 新型冠状病毒(SARS-CoV-2)的传播引起新型冠状病毒肺炎[1](coronavirus disease 2019, COVID-19)的世界性大流行, 患者感染后有发热、干咳、乏力等症状, 重症病例出现呼吸困难并发展为呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)[2, 3, 4]。新型冠状病毒及其突变株引发的疫情传播范围广, 持续周期长, 已经严重威胁人类的健康和社会的稳定[5]。
新型冠状病毒属于套式病毒目(Nidovirales)冠状病毒科(Coronaviridae), 具有囊膜(envelope)、直径约80~120 nm, 基因组全长约27~32 kb, 是已知基因组最大的线性单正链RNA病毒[6]。其基因组共编码29种蛋白, 主要包含四种结构蛋白:刺突蛋白(S), 膜蛋白(M), 包膜蛋白(E)和核衣壳蛋白(N)[7]。其包膜最外层的S蛋白(spike protein)[8]主要负责病毒与宿主细胞的相互识别、穿入和膜融合, 可介导冠状病毒进入易感细胞。作为高致病性病毒, 新型冠状病毒的中和抗体实验和空斑滴定实验等需在生物安全三级(BSL-3)实验室开展。假病毒由于缺乏完整复制机制, 感染一次易感宿主细胞后便不具有感染力[9], 可在生物安全二级(BSL-2)实验室进行。如果在该假病毒系统中插入绿色荧光蛋白基因或者荧光素酶报告基因[10], 则可通过荧光显微镜、流式细胞仪及化学发光等方法更加直观、简便地检测其感染效率。基于以上情况, 本次研究拟建立并优化新型冠状病毒假病毒颗粒的包装方法, 应用于血清中和抗体检测, 并对新冠疫苗的免疫保护效果进行评估。
1.1.1 细胞株、质粒、感受态细胞和血清 人源胚肾细胞(HEK293T)、非洲绿猴肾细胞(Vero)由深圳市第三人民医院肝病研究所张国良课题组保存。过表达ACE2受体的人源胚肾细胞(293T-hACE2)、人肝癌细胞(Huh7.5)由中国科学院上海生命科学院提供。过表达ACE2受体的人肺癌肺泡基底上皮细胞(A549-hACE2)由汕头大学· 香港大学联合病毒学研究所提供。真核表达载体pcDNA3.1及慢病毒骨架载体pNL4-3.Luc.R-E-由复旦大学基础医学院姜世勃教授实验室惠赠; S基因的密码子优化和合成委托生工生物公司进行。大肠杆菌DH5α 感受态购自北京全式金生物有限公司。新冠疫苗免疫后血清由深圳市血液中心提供。
1.1.2 主要试剂及工具酶 细胞培养所用试剂(DMEM培养基、胎牛血清FBS、100× Hepes、100× 青链霉素等)均购自GIBCO公司。限制性内切酶BamHⅠ 和XhoⅠ 购自BioLabs公司; Taq聚合酶购自TaKaRa公司; 同源重组试剂购自Vazyme公司; 小量抽提质粒试剂盒购自北京全式金公司, 胶回收试剂盒和质粒大量抽提试剂盒购自Omega公司。质粒转染试剂VigoFect购自北京威格拉斯生物技术有限公司, 兔抗SARS-CoV-2 刺突蛋白-S和羊抗兔血清总IgG购自ProteinTech公司。萤火虫荧光素酶检测试剂盒购自Promega公司。新型冠状病毒IgG抗体检测试剂盒(酶联免疫法)购自北京万泰生物药业股份有限公司。
1.2.1 插入SARS-CoV-2 S基因真核表达载体的构建 SARS-CoV-2武汉株S基因全序列(NC_045512)由GenBank获得, 全长3 822 bp。依照同源重组试剂说明书设计扩增S基因全长的PCR引物(表1), 通过PCR扩增获得目的片段。反应条件为: 95 ℃预变性2 min; 95 ℃变性1 min, 58 ℃退火1 min, 72 ℃延伸 4 min, 循环30次; 最后72 ℃延伸7 min, PCR扩增产物用0.8%~1.0%琼脂糖凝胶电泳检测。另外, 使用限制性内切酶BamHⅠ 和XhoⅠ 对真核表达载体pcDNA3.1进行双酶切, 采用DNA琼脂糖凝胶纯化试剂盒回收S基因PCR产物和载体双酶切线性化的pcDNA3.1载体。按照无缝克隆[11]的方法将S基因片段与线性化的pcDNA3.1质粒进行同源重组, 将上述同源重组产物直接用于转化DH5α 感受态细菌, 使用含有青霉素抗性(AMP+)的LB固体培养基后挑取单克隆菌落扩大培养, 采用菌液PCR和双酶切的方法筛选阳性克隆, 对于酶切验证正确的阳性克隆小量抽提质粒, 并委托生工生物有限公司进行测序鉴定。
| 表1 扩增SARS-CoV-2 S基因的引物序列 Table 1 The primer sequences used for amplification of S protein gene of SARS-CoV-2 |
1.2.2 SARS-CoV-2假病毒的包装 使用转染试剂VigoFect将质粒pNL4-3.Luc.R-E- 和pcDNA3.1-S 共转染293T细胞。转染24 h前在10 cm培养皿中加入8× 106个293T细胞, 转染前更换新鲜的无血清DMEM培养基。质粒和转染试剂VigoFect分别用一定体积的注射用生理盐水稀释混匀, 室温静置5 min, 再将稀释后的转染试剂逐滴加入质粒稀释管中混匀, 室温静置15 min。之后将上述混合物逐滴均匀加入细胞中[12]。转染6 h后更换为不含抗生素的完全培养基进行培养。同时单独转染骨架质粒pNL4-3.Luc.R-E- 作为阴性对照。48 h后收获细胞上清, 4 ℃ 5 000 × g离心10 min弃除细胞和细胞碎片, 用0.45 μ m滤膜过滤后分装, 避免反复冻融, -80 ℃保存待用。
1.2.3 SARS-CoV-2 假病毒S蛋白的表达验证 为确立包装的SARS-CoV-2假病毒粒子是否表达S蛋白, 设置3组实验组及1组对照组, 分别转染293T细胞:共转染质粒组(pNL4-3.Luc.R-E- 4μ g + pcDNA3.1-S 1 μ g)、骨架质粒组(pNL4-3.Luc.R-E- 4μ g)、表达质粒组(pcDNA3.1-S 1μ g)、空白对照组(不转染质粒); 转染后收集病毒上清浓缩后备用, 同时裂解细胞提总蛋白, 用BCA法分别测定上清和细胞裂解物的蛋白浓度, 煮沸处理样本后进行SDS-PAGE并转移至PVDF 膜, 按照常规的方法进行Western blot 分析[13]。其中一抗为兔抗SARS-CoV-2 S2(1∶ 5 000稀释); 二抗为羊抗兔 IgG 抗体(1∶ 5 000稀释), 内参使用抗Tublin蛋白的抗鼠IgG 抗体。
1.2.4 确定假病毒包装质粒共转染比例 为模拟天然病毒颗粒的组成, 提高假病毒的包装效率, 试验共采用了6种不同比例的pNL4-3.Luc.R‐E-和pcDNA3.1-S质粒进行共转染(质粒总量为5 μ g), 分别为:A组(1∶ 1); B组(2∶ 1); C组(4∶ 1); D组(6∶ 1); E组(8∶ 1); F组(10∶ 1)。按上述6种比例分别转染293T 细胞, 转染48 h后收获上清进行假病毒滴度测定。
1.2.5 整合SARS-CoV-2 S蛋白假病毒易感靶细胞的筛选 为筛选更适合作为整合SARS-CoV-2 S蛋白假病毒的易感细胞, 选择Vero、Huh7.5、A549-hACE2、293T-hACE2 4种细胞株作为候选靶细胞。将上述细胞在假病毒感染前24 h分别铺板于96孔板, 细胞密度达到50%~60%时, 用含2%FBS的DMEM培养基稀释假病毒后加入细胞孔, 吸附约12 h后更换为新鲜的含10%FBS的DMEM培养基。48 h后检测细胞内萤火虫荧光素酶的活性(relative luciferase unit, RLU), 确立假病毒的感染活性[14]。萤火虫荧光素酶活性检测根据Promega提供的说明书进行。
1.2.6 ELISA及假病毒中和试验检测血清抗体水平 首先分别收集接种了新冠疫苗第一针(第一周和第四周后)和第二针(第一周和半年后)的志愿者血清, 用ELISA试剂盒检测血清中新型冠状病毒IgG抗体的水平。按万泰试剂盒的说明书进行检测, 以样本(sample)的吸光度和临界值(cut-off)的比值(S/CO)作为抗体水平的量度。选择IgG滴度高的血清进行后续中和抗体试验, 用体外中和试验评价接种新冠疫苗免疫后血清的中和抗体活性。开始实验前24 h, 按每孔2× 104个/100 μ L将293T-hACE2细胞铺于96 孔板中。将血清用含2%FBS 的DMEM 进行3倍系列稀释, 稀释度为3-1~3-8, 然后取50 μ L 稀释后的血清样本与50 μ L稀释于含2% FBS DMEM 培养基的假病毒液混合, 37 ℃放置1 h, 取100 μ L混合物加入细胞孔, 12 h后补充DMEM 100 μ L完全培养基, 37 ℃培养48 h, 检测萤火虫荧光素酶(RLU)的表达。其中每个稀释度做3个重复孔, 病毒对照孔为含2% FBS DMEM 培养基和假病毒的混合物。感染抑制率(%)= (1-血清组RLU/ 病毒对照组RLU)× 100%[13]。经稀释后能达到50%以上感染抑制率的血清抗体被认为具有中和活性。
根据GenBank上SARS-CoV-2武汉株S基因的全序列(NC_045512)进行密码子优化和化学合成, 并将该序列插入PUC57载体上。设计扩增S基因的全长引物并引入无缝克隆的接头序列, 获得重组表达载体pcDNA3.1-S 。
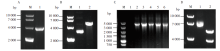
为验证S基因的插入, 通过PCR扩增获得与预期大小相符的目的片段(3 879 bp, 图1A)。用BamHⅠ 和XhoⅠ 双酶切表达载体pcDNA3.1(图1B), 双酶切后的线性化载体和S基因片段经琼脂糖回收后, 按无缝克隆的方法进行同源重组。随后将该重组产物转化DH5α 感受态细胞, 对阳性单克隆菌落分别进行菌液PCR验证, 片段大小均与预期相符合(图1C)。使用BamHⅠ 和XhoⅠ 双酶切对重组质粒进行鉴定, 结果显示双酶切后分别出现大小为5.0 kb和4.0 kb的条带, 分别与pcDNA3.1质粒片段和S基因片段大小相符(图1D)。将该重组质粒测序, 结果显示S基因全序列正确并成功克隆入pcDNA3.1表达载体, 获得含有SARS-CoV-2 S基因的重组表达载体(pcDNA3.1-S)。
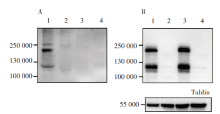
图2A显示泳道1出现2条条带, 自上而下蛋白分子量大小分别为210 000和120 000, 与修饰后的S蛋白和裂解后的S1、S2蛋白大小相符。因此双质粒共转染可在上清中产生表达S蛋白的SARS-CoV-2假病毒。而单独转染pNL4-3.Luc.R-E- 或pcDNA3.1-S均不能产生特异性的S蛋白条带(泳道2、3)。图2B显示共转染双质粒(泳道1)或仅转染pcDNA3.1-S质粒(泳道3)的细胞中均可表达出S蛋白, 泳道中出现的2条条带分子量大小与A图对应; 而转染了pNL4-3.Luc.R-E- 质粒的对照组(泳道2), 则未出现特异性条带。表明包装后的假病毒已经能够正确表达全长的SARS-CoV-2 S蛋白, 且假病毒能释放到上清液中。
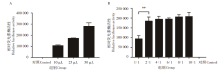
分别用10、25和50 μ L 共转染后的SARS-CoV-2假病毒上清感染293T-hACE2细胞株, 当假病毒用量为10 μ L时RLU值即可达到105(图3A), 因此选择10 μ L用作后续试验的感染用量。6种不同骨架质粒和表达质粒配比的转染条件均检测到了荧光素酶信号。其中在转染条件2∶ 1(pNL4-3.Luc.R‐E- :pcDNA3.1-S)时获得的假病毒滴度与转染条件1∶ 1时相比, 荧光素酶活性升高(P< 0.01, 图3B)。随着两种质粒配比增大, 荧光素酶活性有少许增加, 但差异无统计学意义(图3B)。考虑到质粒比例及用量, 后续实验选择2∶ 1作为双质粒系统包装的配比比例。
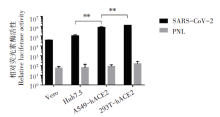
使用10 μ L SARS-CoV-2假病毒上清液感染常用的新冠病毒易感野生细胞株Vero和Huh7.5, 及重新构建的ACE2受体过表达细胞株293T-hACE2和A549-hACE2, 以仅转染pNL4-3.Luc.R-E- 质粒的细胞上清作为阴性对照。通过不同感染时间点检测细胞内荧光素酶活性RLU值, 发现上述四种不同细胞都能被假病毒感染, 但Huh7.5的感染效率优于Vero细胞; 过表达ACE2受体的细胞株优于前两个细胞株(P< 0.01)。在相同感染背景下293T-ACE2细胞株的RLU值最高, 10 μ L的假病毒感染体积RLU值超过105。上述结果证明293T-hACE2和A549-hACE2可作为该假病毒感染的最佳靶细胞。见图4。
本次研究共收集9例接种两针新冠疫苗的志愿者血清, ELISA法检测接种新冠疫苗第一针及第二针后的新型冠状病毒IgG抗体滴度, S/CO值> 1说明IgG检测结果呈阳性。结果发现接种第一针新冠疫苗一周后血清IgG较低; 接种第二针疫苗一周后血清IgG滴度升高, 半年后血清IgG滴度降低(F=36.07, P< 0.001)(图5A)。根据上述结果选择3例IgG阳性(S/CO值分别为10.32、10.06和14.43)的血清进行假病毒中和实验(图5B), 其中血清样本1(Serum-1)的抗体可抑制假病毒的感染活性, 当血清稀释至1/1 066时, 仍具有50%的抑制率, 因此血清中和抗体滴度为1/1 066(图5C)。该结果表明本文建立的SARS-CoV-2假病毒技术可用于新冠中和抗体活性检测及接种新冠疫苗后的血清抗体活性评价。
现阶段国内由SARS-CoV-2引起的新冠肺炎疫情暂时得到了控制, 但由于病毒变异速度快, 各国控制措施不当导致疫情在美国、英国、意大利、南非、印度等国家和地区快速蔓延[4], 推广接种新型冠状病毒疫苗已经成为有效控制新冠疫情的重要手段[15, 16, 17, 18]。SARS-CoV-2 作为高致病性病原微生物, 实验操作需要在具备相应资质的生物安全三级实验室内开展, 这成为制约疫苗研发与保护效果评价的瓶颈。基于HIV骨架进行包装的假病毒可在较大程度上替代活病毒进行疫苗评价, 具有较高的安全性[9]。因此, 从生物安全和实验的可操作角度考虑, 本研究拟以慢病毒包装的双载体系统为基础, 构建复制缺陷型的SARS-CoV-2假病毒颗粒, 从而为新冠中和抗体活性筛选和疫苗免疫效果评估提供一个便捷的实验平台。
慢病毒骨架载体也称包装质粒(packaging vector), 是以HIV基因组结构蛋白为基础, 保留了gag和pol蛋白编码区域, 同时敲除env基因, 并插入萤火虫荧光素酶(firefly luciferase, Fluc)报告基因, 该质粒命名为pNL4-3.Luc.R-E-。包膜质粒(envelope vector)则是将SARS-CoV-2 S基因序列插入真核表达载体pcDNA3.1的CMV启动子下进行表达。由于质粒pNL4-3.Luc.R-E-不具有编码Env蛋白及S蛋白的能力, 因此所形成的假病毒颗粒仅能进行单轮感染, 安全性高; 同时质粒pNL4-3.Luc.R-E-中引入荧光素酶标记基因, 可以通过化学发光法对荧光素酶活性进行测定, 从而反映假病毒对细胞的感染活性。
在病毒包装上, 我们通过优化了双质粒的转染配比, 可大大提高假病毒的包装效率。与等比例混合的方案相比, 当提高pNL4-3.Luc.R‐E- 质粒的比例时, 共转染获得的假病毒滴度明显升高。如当pNL4-3.Luc.R‐E-∶ pcDNA3.1-S为2∶ 1, 总量为5 μ g时, 包装效率提高近1倍。继续提高pNL4-3.Luc.R‐E-的比例, 效果并没有呈现出更显著的提高。考虑到质粒的用量, 后续实验拟选择2∶ 1作为质粒共转染的实用比例。本文通过对假病毒靶细胞进行筛选, 发现过表达了S蛋白识别受体血管紧张素转化酶2(hACE2)[18]的293T-hACE2和A549-hACE2细胞, 均有较好的感染效果, 其中尤以293T-hACE2细胞为最好。将本研究中成功构建包装的SARS-CoV-2假病毒应用在已接种新冠疫苗志愿者的血清中和试验中, 发现具有高水平新冠特异性IgG抗体的免疫血清, 对该假病毒粒子也有较显著的抑制活性, 这表明该体系可较好地用于新冠疫苗免疫保护效果的评价, 从而为COVID-19患者体内中和抗体的筛选、疫苗免疫效果的评估, 以及其他相关的研究提供了一种良好的工具。
本方法的不足之处在于:该假病毒体系的主要应用是可以针对新型冠状病毒S蛋白抗原位点的单克隆抗体、多肽及血清, 进行大批量筛选实验, 但如果能进一步结合新型冠状病毒活病毒的中和实验, 对阳性样品的中和活性进行分析, 结果会更加有说服力。
利益冲突声明 所有作者声明不存在利益冲突
编辑:黄艳 符式刚
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|